2.1 Il nucleo
La parola atomo etimologicamente significa indivisibile, in quanto si pensava che fosse la più piccola particella si sostanza non ulteriormente divisibile. In realtà oggi sappiamo che è composto da un nucleo nel quale sono presenti neutroni e protoni e da una nube di elettroni che circonda il nucleo.
| Particella | Massa relativa (al protone) | Carica relativa (al protone) | |
|
Nucleoni |
Protone | 1 | +1 |
| Neutrone | 1 | 0 | |
| Elettrone | 1/1836 | -1 |
I protoni sono particelle subatomiche che possiedono una carica elettrica positiva che assumiamo di valore unitario e i neutroni sono particelle subatomiche neutre. Insieme sono chiamati nucleoni. Protone e neutrone hanno la stessa massa che consideriamo unitaria e la chiamiamo unità di massa atomica – uma.
Gli elettroni invece hanno una carica molto piccola rispetto ai protoni (1/1836) e possiedono una carica elettrica negativa, uguale ed opposta a quella dei protoni.
Il numero di protoni è fondamentale per caratterizzare la natura dell’elemento chimico perché determina il numero di elettroni che saranno presenti attorno al nucleo. Ad esempio il carbonio possiede 6 protoni che hanno una carica complessiva +6 capace di tenere attratti 6 elettroni. Il comportamento chimico è dato dal numero di elettroni perché sono loro ad interagire tra atomo ed atomo nel formare legami.
La composizione del nucleo viene definita da due numeri: il numero atomico ed il numero di massa.
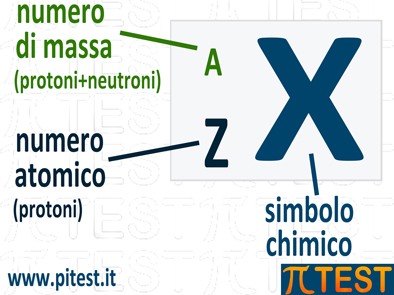 |
| A | Numero di massa | Numero di protoni+neutroni |
| Z | Numero
atomico |
Numero di protoni |
Ad esempio la scrittura:
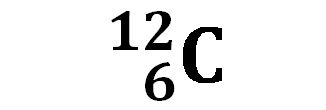 |
indica il carbonio che possiede 6 protoni e 12 nucleoni. Se vogliamo ricavare il numero di neutroni presenti basterà calcolare A–Z = 12 – 6 = 6.
Per i primi venti elementi chimici, dall’idrogeno al calcio, possiamo dire che il numero di neutroni è più o meno uguale a quello dei protoni.
2.1.1 Gli isotopi
La presenza dei neutroni nel nucleo ha la funzione di stabilizzare il nucleo stesso. I protoni da soli, a causa della carica elettrica uguale, tenderebbero a respingersi al punto di disintegrare il nucleo stesso. L’aumento di massa dovuto alla presenza dei neutroni stabilizza il nucleo perché aumenta la forza di attrazione tra nucleoni, detta forza nucleare forte, forza che si oppone alla repulsione elettrostatica tra protoni. Inoltre i neutroni svolgono la funzione di tenere i protoni più lontani uno dall’altro facendo diminuire le forze repulsive.
Per quasi tutti gli elementi chimici esistono diverse possibilità per il numero di neutroni presenti ed esistono così diversi isotopi di uno stesso elemento chimico.
Ciascun isotopo a volte è chiamato con il generico temine di nucleotide.
In natura i diversi isotopi sono presenti con una distribuzione isotopica, cioè secondo percentuali note.
MASSA ATOMICA REALE
La massa atomica reale di un elemento che si legge nella tavola periodica degli elementi è determinata dalla distribuzione percentuale dei diversi isotopi presenti in natura. Ad esempio se andiamo a leggere i dati relativi all’idrogeno nella tavola periodica degli elementi troviamo per la massa atomica il valore 1,0079. Tale valore deriva dal calcolo della media ponderale effettuata sulle abbondanze isotopiche.
Ad esempio per il cloro sono presenti due isotopi: il Cloro 35, 35Cl, con massa atomica di 34,97 presente al 75,77% ed il Cloro 37, 37Cl, con massa atomica di 36,97 presente al 24,23%. La massa atomica media si calcola come media ponderale delle abbondanze isotopiche:
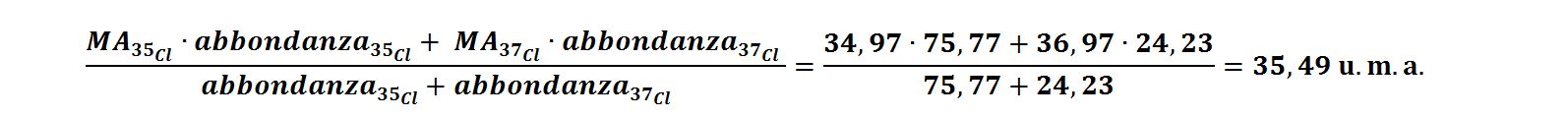
Valori da ricordare
Al fine dei calcoli nei quiz i valori di massa atomica di alcuni elementi sono sempre considerati approssimati a valori unitari. È bene ricordare ai fini della soluzione dei quiz i seguenti valori:
| Elemento | MA | Composto | MM | |
| H | 1 | H20 | 18 | |
| C | 12 | CO2 | 44 | |
| N | 14 | CaCO3 | 100 | |
| O | 16 | H2SO4 | 98 | |
| Ca | 40 | |||
| Cl | 35,45 |
Esempi di isotopi di idrogeno, carbonio e cloro
|
Idrogeno H |
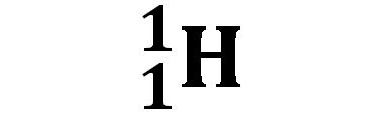 |
 |
 |
| Prozio | Deuterio | Trizio | |
| 99,985% | 0,015% | tracce | |
|
Carbonio C |
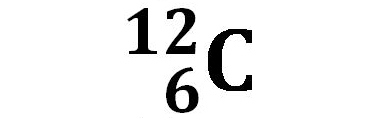 |
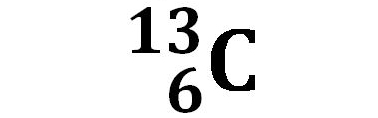 |
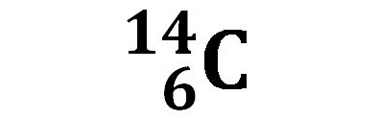 |
| 98,93% | 1,07% | <10-12% | |
|
Cloro Cl |
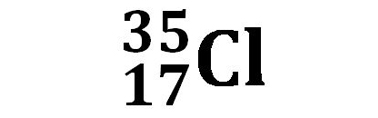 |
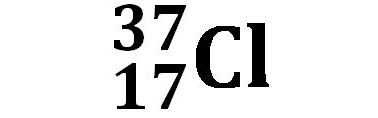 |
|
| 75,77% | 24,23% |
2.1.2 Alcuni isotopi “importanti” e le reazioni nucleari
L’idrogeno presenta in natura tre isotopi ai quali è stato assegnato un nome. Il prozio 1H possiede nel nucleo solo un protone ed è la forma isotopica più diffusa in natura (99,985%); il deuterio 2H possiede un neutrone in più ed è noto per la sua presenza nell’acqua pesante, una variante isotopica dell’acqua nella quale gli atomi di idrogeno sono presenti nella forma isotopica del deuterio 2H2O (acqua con due atomi di deuterio) o 1H2HO (acqua con un atomo di deuterio e uno di prozio). Fisicamente e chimicamente è simile all’acqua ed è famosa per il suo ruolo di moderatore nei reattori nucleari. Il terzo isotopo, il trizio 3H, è raro.
L’uranio presenta due forme isotopiche importanti 235U e 238U . 235U è presente in natura solo allo 0,7% ma è utilizzato per le reazioni di decadimento nucleare nelle centrali elettriche e per gli ordigni atomici. Per questo motivo vengono effettuare operazioni di “arricchimento dell’uranio” per aumentare la percentuale di 235U.
L’isotopo del carbonio al quale si fa normalmente riferimento è il 12C , ed è la forma isotopica più abbondante in natura (98,93%). 14C, l’isotopo 14 del carbonio, è presente nel nostro pianeta solo in piccolissima percentuale. Viene però preso in considerazione nella datazione di reperti organici antichi. Il 14C è sottoposto ad una reazione di decadimento radioattivo nella quale un neutrone del nucleo si trasforma in un protone con la nascita di un elettrone:
n➝p+ + e‒
Il nucleo si ritrova così con un protone in più e l’atomo da Carbonio diventa Azoto in quanto il numero atomico aumenta di una unità. Il numero di massa non varia perché il numero totale di nucleoni è invariato. La mutazione avvenuta è una reazione nucleare perché coinvolge la natura del nucleo. Può essere scritta così:
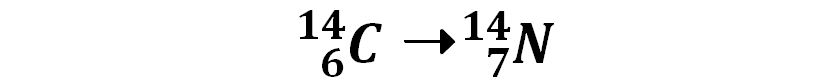
Questa reazione può essere letta come una trasformazione nella quale la quantità di Carbonio 14 diminuisce. Per questo tipo di reazioni si considera il “tempo di emivita” o “tempo di dimezzamento” che è il tempo necessario affinché la quantità iniziale del 14C si dimezzi. Il tempo di emivita del 14C è di 5730 anni, un arco di tempo paragonabile alla storia dell’uomo sul pianeta. Una forma di vita biologica vivente fissa nei composti organici che la costituiscono una quantità percentuale di 14C pari a quella presente sul pianeta. Dopo la morte del sistema vivente, 14C non si rinnova più ed inizia il decadimento radioattivo. Da una analisi di laboratorio della percentuale di 14C presente in un reperto archeologico si può risalire alla datazione del reperto stesso.
2.1.3 Decadimento radioattivo
Il processo di decadimento radioattivo per il quale è noto il tempo di dimezzamento può essere interpretato matematicamente con una legge esponenziale con base 1/2. Chiamiamo τ il tempo di dimezzamento. Ogni volta che trascorre un tempo τ la quantità si dimezza.
Consideriamo l’esempio del Carbonio 14:
| Inizio | τ | 2 τ | 3 τ |
| 0 anni | 5730 anni | 11460 anni | 17190 anni |
| Quantità iniziale | 1/2 | (1/2)2 = 1/4 | (1/2)3 = 1/8 |
| 100% | 50% | 25% | 12,5% |
2.1.4 Radiazioni
Alcune particelle subatomiche quando si creano a seguito di reazioni nucleari hanno una elevatissima energia cinetica e viaggiano sotto forma di radiazioni.
Classificazione delle radiazioni:
Raggi α: si tratta di particelle pesanti costituite da due protoni e due neutroni ed assomigliano in toto al nucleo dell’elio He. Si generano da reazioni di decadimento nucleare. Sono poco penetranti.
Raggi β: si tratta di elettroni prodotti da reazioni nucleari. A volte sono costituiti da positroni, ovvero elettroni positivi; si distinguono perciò in β+ e β–. Hanno un potere ionizzante nei confronti delle sostanze che incontrano.
Raggi X: si tratta di onde elettromagnetiche molto penetranti, pericolose per gli esseri viventi. Il loro potere penetrante è tale che riescono ad attraversare i tessuti molli, ma non le ossa. Questo ne giustifica l’uso nelle radiografie.
Raggi γ (gamma): Sono onde elettromagnetiche più energetiche e penetranti dei raggi X, mortali per qualsiasi forma di vita.
2.1.5 Unità di massa atomica
Un nucleone, protone o neutrone, corrisponde ad una unità di massa atomica u.m.a. oppure uma.
Un atomo con numero di massa A possiede una massa di A u.m.a.
Esempio: l’ossigeno 16O ha una massa di 16 u.m.a.
1 u.m.a. per definizione corrisponde ad 1/12 della massa del carbonio 12C. La scelta di far riferimento al carbonio 12 deriva dal fatto che il carbonio presente nel petrolio e nel carbone presenta una elevatissima purezza dell’isotopo 12 e per questo è facilmente recuperabile in natura.
1 u.m.a. ha la massa di 1,66·10−27 kg. Valore da ricordare a memoria per rispondere ai quiz.
Si giunge a questo valore dividendo il peso in grammi di una mole di u.m.a., cioè 1 grammo, per il numero di Avogadro: 1/(6,023·1023)=1,66·10−24 g = 1,66·10−27 kg.
QUIZ - Il Nucleo |
|||
|---|---|---|---|
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito


