7.6 Cinetica Chimica – Velocità di reazione
QUIZ 2
Veterinaria 2019
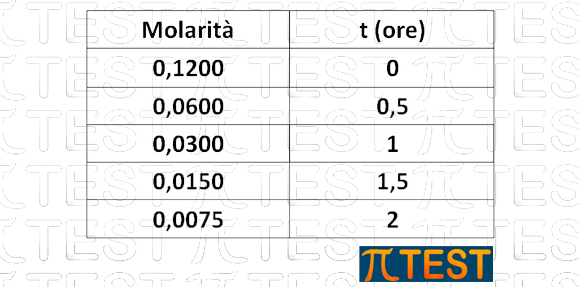
In una reazione di decomposizione di N2O5 (g) la concentrazione iniziale del gas è pari a 0,1200 M. Dopo mezz’ora la concentrazione del gas è scesa a 0,0600 M. Sapendo che la reazione è del primo ordine rispetto a N2O5 quale sarà la concentrazione del reagente dopo due ore?
Si tratta di una reazione del tipo A ➞ B + C [NO5 ➞ NO3 + O2 ]
La velocità di reazione può essere espressa come
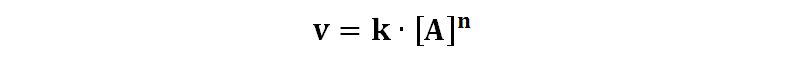
Dove n è detto “ordine di reazione”.
Il quiz ci dice che la reazione è del primo ordine e perciò la velocità segue la legge
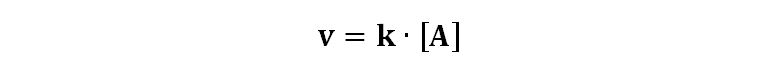
Poiché la concentrazione del reagente va diminuendo via via che la reazione procede, anche la velocità rallenta; l’andamento segue una legge esponenziale con base inferiore ad 1 del tipo
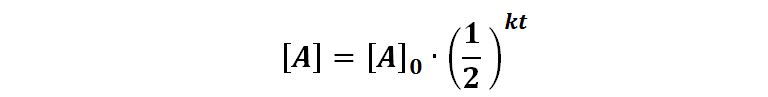
ed avrà un grafico come in figura:
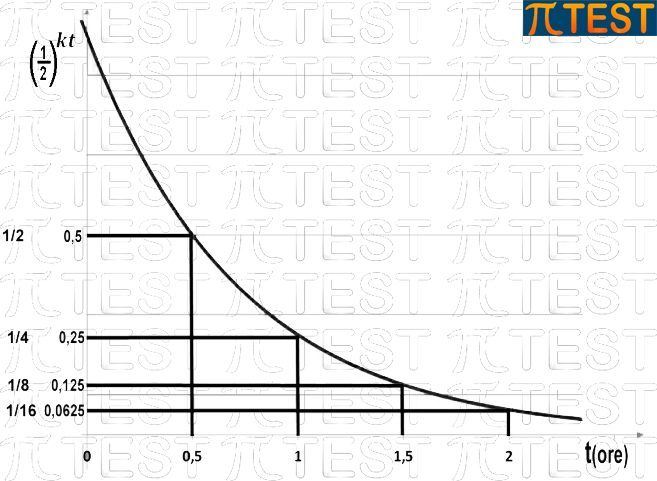
Una legge esponenziale decrescente come questa è anche interpretabile come progressione geometrica di base 1/2.
Possiamo comprendere che si tratta di una progressione geometrica dal fatto che dopo un certo tempo (mezz’ora) il valore si è dimezzato; passa infatti da 0,1200M a 0,0600M.
Procediamo di mezz’ora in mezzora ed avremo altri dimezzamenti progressivi fino ad arrivare al tempo di 2 ore:
QUIZ sulla Velocità di reazione |
|||
|---|---|---|---|
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito


