1,9K
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito
6.5 Ossidoriduzioni
QUIZ 14
Veterinaria 2002
Nella reazione:
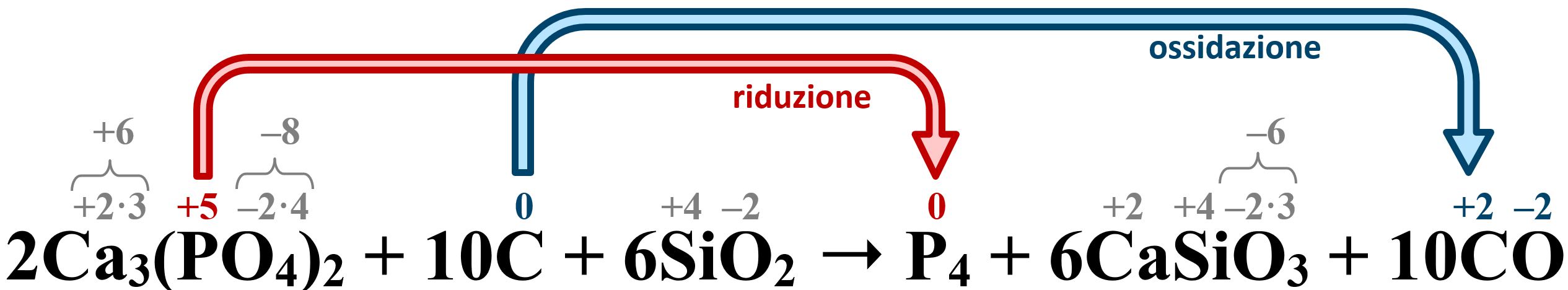
2 Ca3(PO4)2 + 10 C + 6 SiO2 → P4 + 6 CaSiO3 + 10 CO :
Correct!
Wrong!
quiz 6.5 Ossidoriduzioni - 14
Nota (1)
Per riuscire a valutare il numero di ossidazione di tutti gli elementi presenti dobbiamo conoscere le regole fondamentali di attribuzione (1). In particolare:
- L’ossigeno O è presente sempre nel suo stato ridotto ‒2
- Il calcio Ca, appartenente al secondo gruppo, è presente sempre nel suo stato ossidato +2 (unico possibile valore)
- Il silicio Si, appartenente al quarto gruppo, è presente sempre nel suo stato ossidato +2
- Il fosforo P è presente tra i reagenti sotto forma di fosfato PO43‒, ione derivante dall’acido ortofosforico H3PO4. È invece presente nei prodotti nel suo stato di elemento con numero di ossidazione pari a zero
- Il carbonio C è presente tra i reagenti come elemento con numero di ossidazione pari a zero e tra i prodotti nel monossido di carbonio con numero di ossidazione +2

A questo punto è facile individuare la risposta E): il fosforo si riduce e il carbonio si ossida.
Nota (1)
Le principali regole dei numeri di ossidazione sono:
- il numero di ossidazione di tutte le sostanze elementari è uguale a zero (es. Na, Mg, Fe hanno n.o. zero e così pure ogni atomo delle molecole degli elementi, come H2, O2, Cl2, S8);
- in tutti i composti l’ossigeno ha numero di ossidazione −2 (es. MgO), ad eccezione dei perossidi nei quali il n.o. è −1 (es. H2O2, Na2O2);
- in tutti i composti l’idrogeno ha numero di ossidazione +1 (es. HCl, H2O), ad eccezione degli idruri nei quali il n.o. è −1 (LiH, CuH);
- nelle molecole neutre la somma algebrica dei numeri di ossidazione dei singoli atomi è uguale a 0 (es. nell’acqua H2O l’idrogeno ha n.o. +1 x 2 atomi = +2 e l’ossigeno ha n.o. −2 x 1 atomo = −2, quindi +2 −2 = 0);
- gli ioni monoatomici hanno numero di ossidazione uguale alla carica dello ione (es. lo ione rame Cu2+ ha n.o. +2);
- in uno ione poliatomico la somma algebrica dei numeri di ossidazione di tutti gli atomi è uguale alla carica dello ione (es. SO42- ha la somma dei n.o. = −2).
- i metalli hanno solo numeri di ossidazione positivi;
- i non metalli possono avere numeri di ossidazione positivi o negativi;
- gli elementi del primo gruppo (metalli alcalini) hanno sempre n.o. = +1;
- gli elementi del secondo gruppo (metalli alcalino-terrosi) hanno sempre n.o. = +2;
- gli elementi del terzo gruppo hanno sempre n.o. = +3.
- i gruppi pari hanno sempre n.o. pari, quelli dispari (tranne l’azoto) sempre dispari;
- nel quarto gruppo il carbonio ha n.o. = –4, +4 e +2; il silicio –4 e +4; stagno e piombo +4 e +2;
- nel quinto gruppo l’azoto ha n.o. = –3, +1, +2, +3, +4 e +5; il fosforo –3, +3 e +5;
- nel sesto gruppo l’ossigeno ha praticamente sempre –2, lo zolfo ha –2, +4 e +6;
- nel settimo gruppo il fluoro ha sempre –1; gli altri elementi hanno tutti –1, e possono avere i valori +1, +3, +5 e +7;
- gli elementi di transizione non seguono regole particolari, per cui si rinvia alla tavola periodica o alla tabella dei numeri di ossidazione
QUIZ su Ossidoriduzioni |
|||
|---|---|---|---|
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito


