TEST DI AMMISSIONE A MEDICINA ED ODONTOIATRIA
03 settembre 2019
Quiz n°47 – Chimica
Medicina 2019
Lo smalto dei denti è costituito per la maggior parte da idrossiapatite, la cui unità formula è Ca5(PO4)3(OH). In ambiente acido per acido solforico, essa può essere decomposta secondo la seguente reazione:
Ca5(PO4)3(OH) + 4H+ → 5Ca2+ +3HPO42‒ + H2O
Quante moli di H2SO4 sono necessarie per produrre 0,3 moli di ioni HPO42‒?
I rapporti stechiometrici della reazione sono:
1 : 4 → 5 : 3 : 1
Il quiz richiede le moli di H2SO4 anche se questa molecola non risulta presente nella scrittura della reazione.
L’acido solforico H2SO4 è un acido forte che in soluzione acquosa si presenta sempre completamente deprotonato, ovvero avviene idrolisi acida completa e sono presenti 2H+ e SO42-. Il quiz parlando dell’acido solforico in realtà fa riferimento ai quatto H+ che compaiono tra i reagenti in quanto sono messi in gioco dall’acido solforico. Per questo motivo chiedere quante moli di H2SO4 sono necessarie è come chiedere quante coppie di H+ sono necessarie. Stiamo attenti al fatto che una mole di H2SO4 libera due moli di H+.
Ragioniamo ora sui coefficienti stechiometrici per calcolare quante moli di H+ sono necessarie.
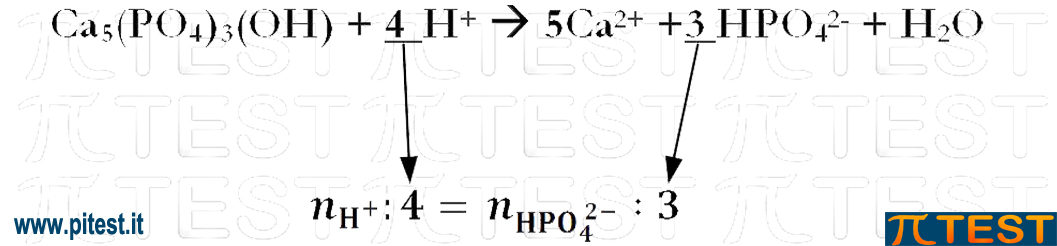
Ricaviamo:
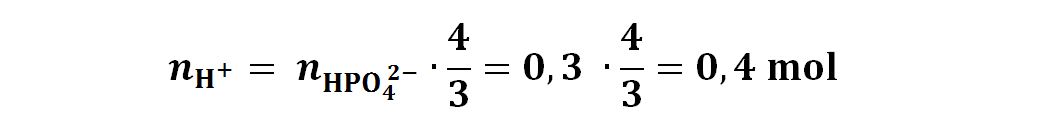
Abbiamo osservato prima che una molecola (o anche similmente una mole) di H2SO4 liber due H+. Le moli di H2SO4 saranno perciò la metà delle moli di H+. Saranno così 0,2 mol.
| Vai al quiz n°48 |
| Rag.logico e Cult.generale |
Chimica | |
| 1 | 21 – 22 | 41 |
| 2 | 42 | |
| 3 | Biologia | 43 |
| 4 | 23 | 44 |
| 5 | 24 | 45 |
| 6 | 25 | 46 |
| 7 | 26 | 47 |
| 8 | 27 | 48 |
| 9 | 28 | 49 |
| 10 | 29 | 50 |
| 11 | 30 | 51 |
| 12 | 31 | 52 |
| 13 | 32 | Matem. e Fisica |
| 14 | 33 | 53 |
| 15 | 34 | 54 |
| 16 | 35 | 55 |
| 17 | 36 | 56 |
| 18 | 37 | 57 |
| 19 | 38 | 58 |
| 20 | 39 | 59 |
| 40 | 60 |


