6.2 Stechiometria
QUIZ 03
Medicina 2020
Una camera di scoppio contiene 10 moli di H2 e 7 moli di O2. Quante moli saranno complessivamente presenti in seguito all’esplosione di questa miscela?
L’idrogeno H2 reagisce con l’ossigeno O2 per dare come unico prodotto l’acqua H2O secondo la reazione:
2 H2 + O2 → 2 H2O
Il rapporto stechiometrico è:
2 : 1 → 2
I due regenti non sono presenti secondo il rapporto stechiometrico ma uno è in eccesso e l’altro in difetto.
Iniziamo a ragionare su H2 . Con 10 moli di H2 si consumano solo 5 moli di O2 .
Il numero di moli consumate tra i due reagenti ed il numero di moli prodotte di H2O sono proporzionali ai coefficienti stechiometrici secondo la relazione:
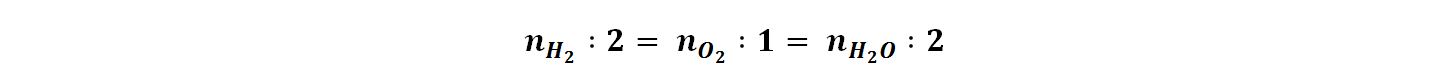
Iniziamo a calcolare le moli consumate di O2 e quelle prodotte di H2O

Poiche l’ossigeno è in eccesso, se ne consumano 5 moli e ne rimangono 7‒5 = 2 moli.
Possiamo rappresentare il risultato dei calcoli in una tabella:
| H2 | O2 | H2O | |
| Inizio | 10 | 7 | 0 |
| Variazione | ‒10 | ‒5 | +10 |
| Fine | 0 | 2 | 10 |
Alla fine nella camera di combustione avremo 12 moli di gas (10 di H2O O prodotta + 2 di O2 non consumato).
In questo tipo di reazione possiamo dire che H2 iè il reagente limitante e O2 è quello limitato.
Possiamo anche affermare che O2 è in eccesso e H2 è in difetto.
Nota: La combustione dell’idrogeno è una reazione che può essere anche esplosiva al pari della combustione degli idrocarburi. Recentemente è stata presa in considerazione per alcuni motori per mezzi di trasposto in quanto è una reazione assolutamente non inquinante.
QUIZ su Stechiometria |
|||
|---|---|---|---|
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito


