Odontoiatria 1998
Secondo la definizione di Bronsted-Lowry, quale dei seguenti ioni può comportarsi solo come acido?
È bene conoscere la definizione di acido e base secondo Brønsted e Lowry (vedi).
Un acido secondo Brønsted è una sostanza in grado di rilasciare ioni H+ e una base è una sostanza in grado di accettare ioni H+. Il quiz ci chiede di individuare una sostanza che può avere SOLO un comportamento acido. Dobbiamo così escludere le sostanza dette anfotere (o anfiprotiche) che, a seconda delle situazioni possono comportarsi da acido o da base. Le sostanze anfotere sono l'acqua e gli ioni derivati da incompleta deprotonazione di acidi poliprotici.
Analizziamo le risposte:
A) Lo ione ammonio NH4+ in acqua si comporta come un acido perché reagisce secondo la reazione:
NH4+ ⇆ + NH3 + H+
o meglio
NH4+ + H2O ⇆ + NH3 + H3O+
Non può avere n comportamento basico in quanto non può accettare ioni H+.
È questo lo ione che cerchiamo. La risposta A) è corretta.
NOTA: Nel risolvere questo quiz è fondamentale individuare per riconoscimento immediato (a memoria) l'acidità dello ione ammonio e determinare subito la risposta A). Altrimenti il riconoscimento degli ioni presenti nelle altre risposte può risultare più complesso.
B) Lo ione fosfito PO33– deriva dalla tripla deprotonazione dell'acido fosforoso H3PO3.
Lo ione non possiede alcun atomo di idrogeno e di conseguenza non può rilasciare alcun H+. Il suo comportamento può essere solo basico.
PO33– + H2O ⇆ HPO3– + OH– (comportamento basico)
C) Lo ione idrogenofosfito HPO32– deriva dalla seconda deprotonazione dell'acido fosforoso H3PO3.
L'acido H3PO3 possiede una struttura molecolare di equilibrio tra due tautomeri, acido fosfonico e acido fosforoso.
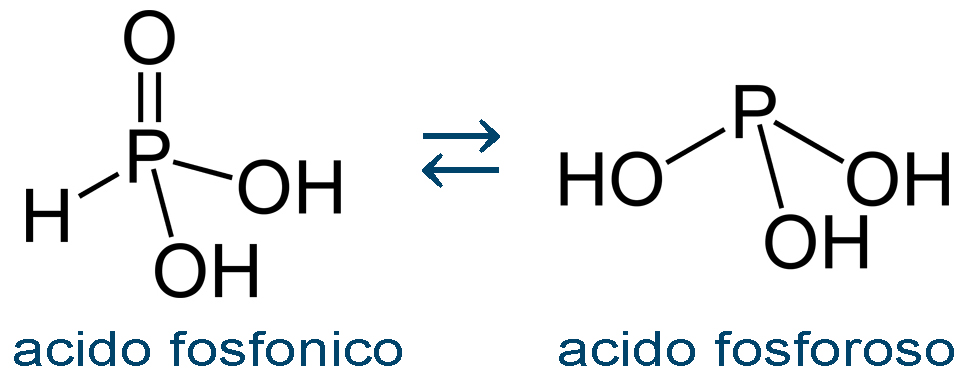
Dei due in natura è preponderante la presenza dell'acido fosfonico che possiede soltanto due atomi di idrogeno idrolizzabili. Di conseguenza H3PO3 è essenzialmente un acido diprotico e lo ione HPO32– non possiede idrogeni deprotonabili. Non è così uno ione acido.
Lo ione HPO32– può invece avere un comportamento basico accettando H+.
Come abbiamo detto nella spiegazione della risposta A), questa conoscenza non è di facile portata per uno studente di preparazione liceale. Si giunge alla risposta del quiz individuando, per riconoscimento immediato, lo ione acido nell'ammonio della risposta A) .
D) Lo ione idrogenofosfato HPO42– deriva dalla seconda deprotonazione dell'acido fosforico (ortofosforico) H3PO4.
Consideriamo i tre ioni che ne derivano dopo le tre possibili deprotonazioni: H2PO42–, HPO42–e PO43–
H3PO4 + H2O ⇆ H2PO4– + H3O+
H2PO4– + H2O ⇆ HPO42– + H3O+
HPO42– + H2O ⇆ PO43– + H3O+
Il comportamento di HPO42– può essere sia acido che basico. Infatti può procedere secondo un comportamento acido con una terza deprotonazione (vedi la reazione scritta qui sopra) oppure secondo un comportamento basico acquistando un ione H+ secondo la reazione basica:
HPO42– + H2O ⇆ H2PO4–+ OH–
Concludiamo che lo ione HPO42– possiede un comportamento anfotero e non è lo ione che cerchiamo.
E) Lo ione idrosolfato HSO4– deriva dalla prima deprotonazione dell'acido solforico H2SO4, acido forte sia in prima che in seconda deprotonazione.
Lo ione di prima deidrogenazione HSO4– possiede, di suo, un comportamento acido, ma può comunque riacquistare un idrogeno comportandosi da base. Sono possibili entrambi i comportamenti seguenti:
HSO4– + H2O ⇆ SO42– + H3O+
HSO4– + H2O ⇆ H2SO4 + OH–
Concludiamo che lo ione HSO4– possiede un comportamento anfotero e non è lo ione che cerchiamo.


