Medicina 2006
Il prodotto ionico dell’acqua KW è, a temperatura costante, :
Quando parliamo di acidità e basicità di una soluzione acquosa facciamo riferimento alla presenza degli ioni idronio H+ o meglio dello ione idronio H3O+ (a volte chiamato ossonio), e degli ioni ossidrile OH‒.
Questi ioni sono presenti per una particolare dissociazione dell’acqua stessa, detta autoprotolisi, oltre che per la possibile presenza di sostanza acide che aumentano la quantità di ioni idronio e di sostanze basiche che aumentano la presenza di ioni ossidrile.
L’acqua (pura, senza altre sostanze disciolte) dà luogo ad una particolare reazione, detta autoprotolisi o autoionizzazione o autodissociazione, per la quale una molecola di acqua di dissocia in due ioni: H+ e OH‒.
(autoprotolisi - 1) H2O ⇆ H+ + OH−
Lo ione H+ è un atomo di idrogeno che ha perso il suo unico elettrone; si tratta così del solo nucleo dell’atomo costituito da un solo protone. Per questo motivo spesso chiamiamo con il termine “protone” lo ione H+.
Il termine protone viene utilizzato anche quando un acido si dissocia rilasciando H+; chiamiamo questa reazione “deprotonazione”.
Lo ione H+ libero però non esiste in natura perché si tratta solo di un protone isolato che si lega ad altri complessi molecolari. In acqua il protone H+ si lega con legame dativo ad una molecola d’acqua formando lo ione idronio H3O+:
H+ + H2O ⭢ H3O+
Considerando che non esiste mai il protone H+, ma esiste lo ione idronio H3O+, possiamo scrivere la reazione di autoprotolisi nella forma:
(autoprotolisi - 2) 2 H2O ⇆ H3O+ + OH−
Dopo questa spiegazione possiamo capire il significato del termine autoprotolisi:
auto = significa che la reazione avviene da sola senza l’intervento di agenti esterni
proto = protone H+, generato dalla lisi della molecola d’acqua
lisi = taglio (la molecola d’acqua si spezza in H+ e OH‒)
Nei diversi testi di chimica e nei diversi quiz a volte troviamo il riferimento allo ione idronio H3O+, altre volte troviamo il riferimento allo ione H+ e altre ancora al termine protone.
Come ogni altra reazione chimica l’autoprotolisi possiede una sua costante di equilibrio (vedi teoria costante di equilibrio). Scriviamo la costante di equilibrio:
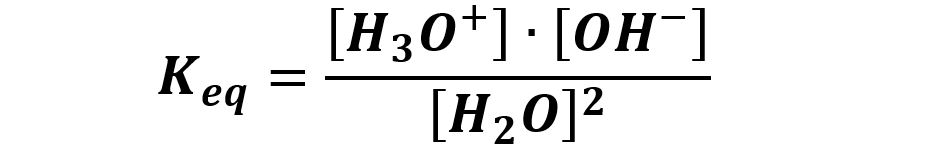
Cercando di eliminare la concentrazione del reagente, l’acqua pura, perché è un valore costante pari alla concentrazione molare dell’acqua nell’acqua stessa che vale 55,5 mol/L, utilizziamo una costante diversa, Kw, detta prodotto ionico dell’acqua:
Kw = Keq · [H2O]2 = [H3O+] · [OH–]
(il pedice W sta per water, acqua)
Così come per tutte le costanti di equilibrio, anche Kw dipende dalla temperatura. Negli esercizi più semplici e quasi sempre nei quiz si fa riferimento al valore di Kw a 25°C (298K) e 1 atm, condizione termodinamica che chiamiamo “CN”, Condizioni Normali (1). Il prodotto ionico Kw in Condizioni Normali vale:
Kw = 10‒14


