Odontoiatria 2003
Stabilire quale delle seguenti soluzioni presenta, a parità di temperatura, la maggiore pressione osmotica:
a) acido cloridrico 0,2 M;
b) acido formico 0,2 M;
c) saccarosio 0,4 M;
d) cloruro di sodio 0,2 M;
e) bicarbonato di magnesio 0,2 M.
La pressione osmotica Π è espressa come:
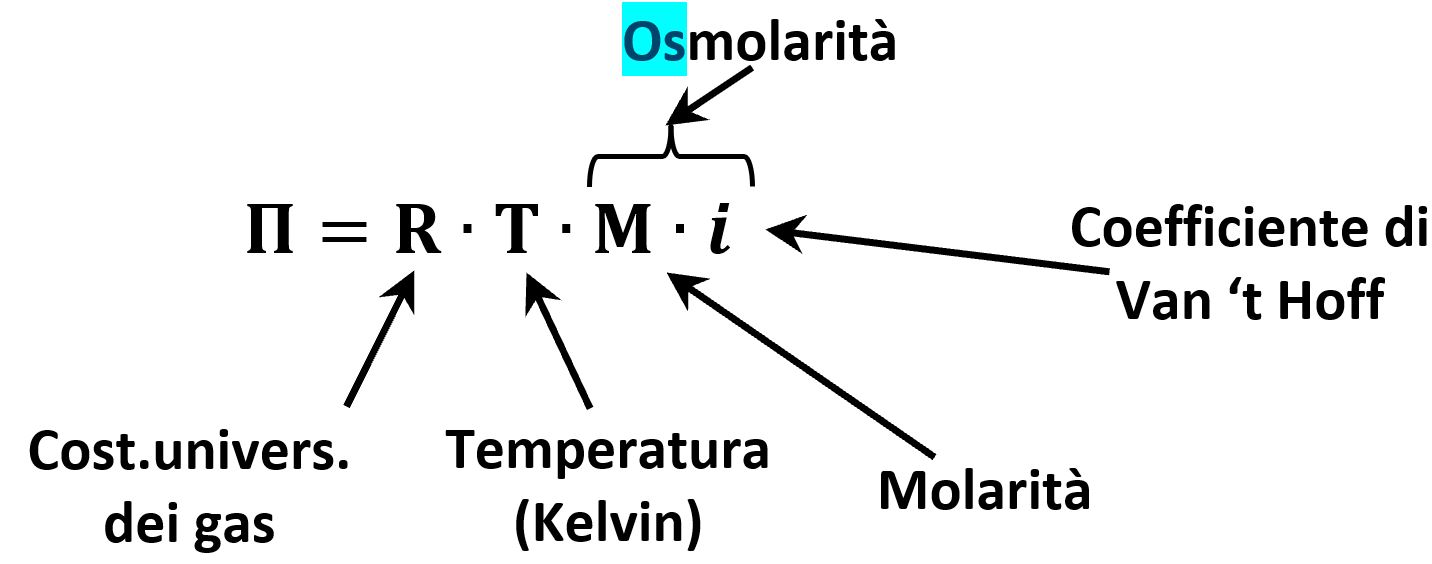
A parità di temperatura la soluzione con maggior pressione osmotica è quella con la più alta osmolarità M·i.
In questo tipo di quiz sono fondamentali i valori del coefficiente di Van't Hoff.
a) L'acido cloridrico HCl è forte e in acqua presenta un'idrolisi completa in H+ e Cl– ; avremo perciò i=2.
M·i = 0,2 · 2 = 0,4
b) L'acido formico HCOOH è debole e in acqua presenta un'idrolisi molto bassa in H+ e HCOO– ; avremo perciò i≅1.
M·i ≅ 0,2 · 1 ≅ 0,2
c) Il saccarosio, disaccaride, in acqua non presenta alcuna idrolisi e perciò i=1.
M·i = 0,4 · 1 = 0,4
d) Il cloruro di sodio NaCl è un sale che in acqua presenta un'idrolisi completa in Na+ e Cl– ; avremo perciò i=2.
M·i = 0,2 · 2 = 0,4
e) Il bicarbonato di magnesio Mg(HCO3)2 è un sale che in acqua presenta un'idrolisi completa in Mg2+ e due ioni HCO3– ; avremo perciò i=3.
M·i = 0,2 · 3 = 0,6
È evidente che la soluzione e) è quella con la più alta osmolarità e di conseguenza con la maggiore pressione osmotica.


