4.5 Ibridazione degli orbitali
QUIZ 11
Medicina 2018
Quale delle seguenti molecole NON è lineare secondo la teoria VSEPR?
Si tratta di un quiz abbastanza difficile per uno studente con preparazione liceale.
La struttura lineare è spesso associata all'ibridazione sp.
I due orbitali sp hanno una forma allungata ibrida che conserva le caratteristiche geometriche dell’orbitale s e dell’orbitale p. In base alla teoria VSEPR gli orbitali sp trovano una distribuzione spaziale che soddisfi il principio di repulsione e si direzionano in modo contrapposto formando un angolo di 180°. La forma è anche detta lineare.
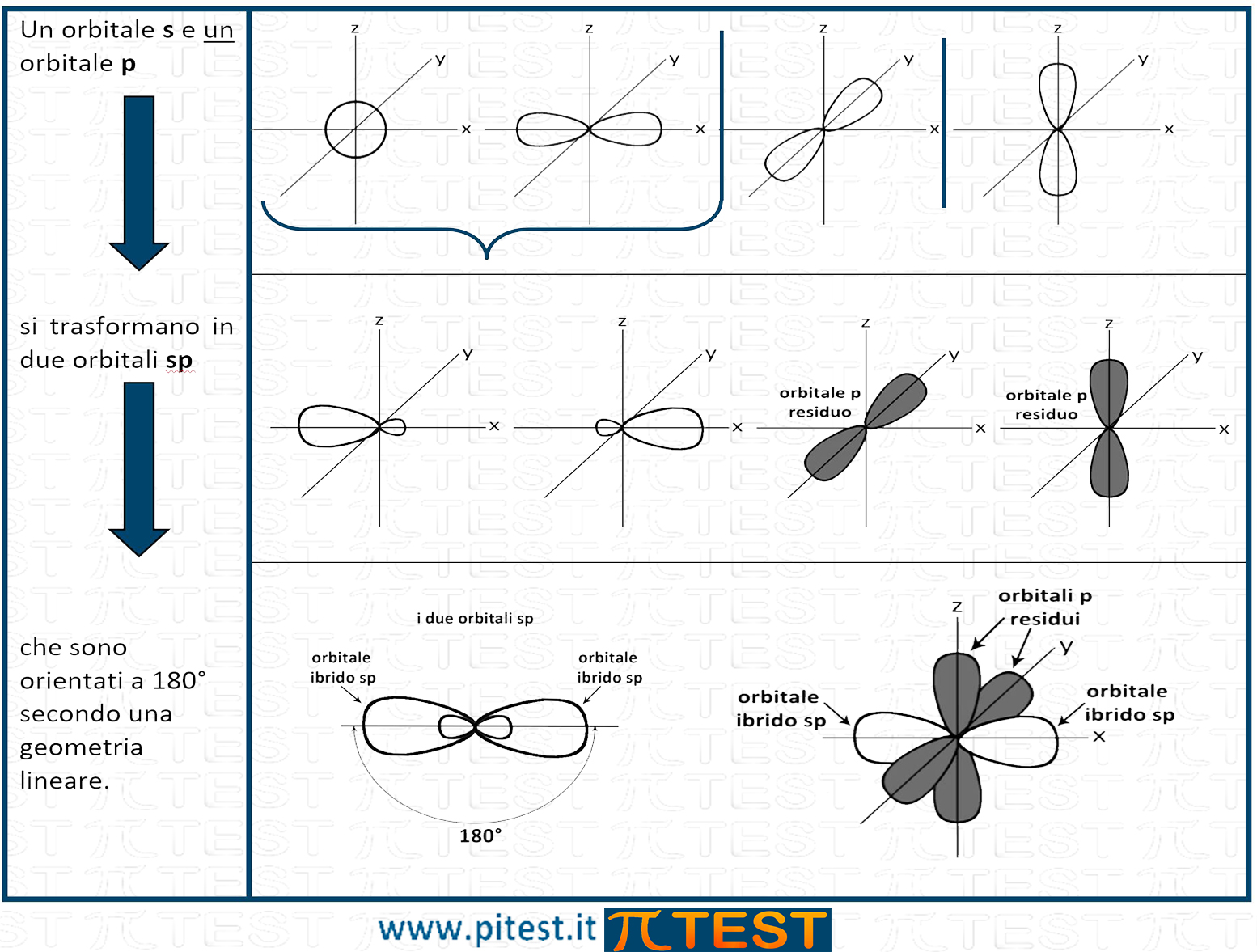
Vediamo i vari composti proposti nelle risposte:
A) CaH2 idruro di calcio
Il calcio possiede due elettroni nel guscio esterno che creano una ibridazione sp che crea una geometria lineare.
H–Ca–H
B) HCN acido cianidrico
Nel gruppo "ciano" -CN il carbonio assume una ibridazione sp che crea una geometria lineare.
Il carbonio con i due orbitali p che non hanno preso parte all'ibridazione dorma il secondo e il terzo legame con l'azoto.
C) CO2
Anche nell'anidride carbonica il carbonio assume una ibridazione sp. Il carbonio con i due orbitali p che non hanno preso parte all'ibridazione forma un secondo legame con ciascuno dei due atomi di ossigeno presenti.
O=C=0
D) C2H2 etino o acetilene.
La molecola che tipicamente si utilizza per rappresentare l’ibridazione sp del carbonio è quella dell’etino (o acetiletilene)
CH≡CH
| Nell’etino i due atomi di carbonio sono entrambi ibridati sp. Tra i due atomi di carbonio c’è un triplo legame: il primo legame σ di forma tra sue orbitali sp dei due atomi di carbonio coinvolti; il secondo ed il terzo legame π si formano tra le due coppie di orbitali p residui. | 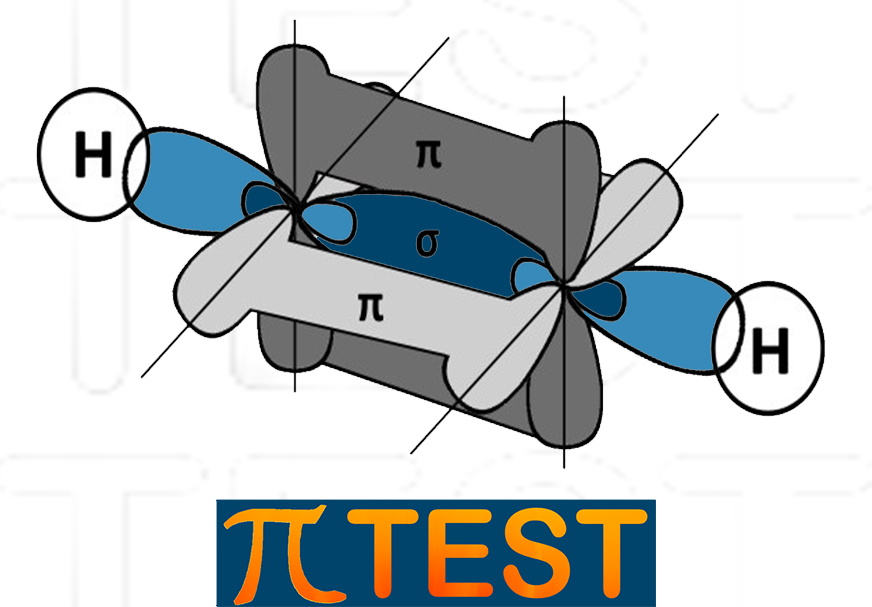 |
E) SO2 anidride solforosa.
| È questa la risposta corretta ed anche la molecola più difficile da conoscere nella sua struttura tridimensionale per uno studente. La molecola possiede una struttura angolare. Lo zolfo forma un doppio legame con un atomo di ossigeno ed un legame dativo con l'altro atomo di ossigeno. |  |
QUIZ Ibridazione degli orbitali |
|||
|---|---|---|---|
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito


