Veterinaria 2005
Secondo Bronsted:
Studiando la teoria (vedi) abbiamo il rapporto tra la costante di equilibrio di un acido e quella della sua base coniugata.
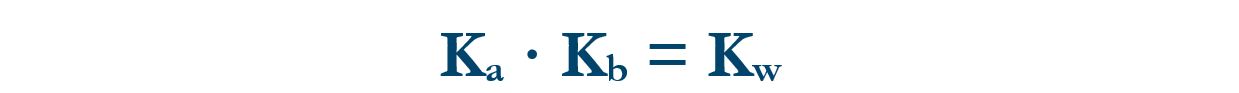
Dove Kw è la costante di autoprotolisi dell’acqua che vale 10‒14. Di conseguenza valgono le relazioni che esprimono la proporzionalità inversa tra Ka e Kb.

Da queste relazioni di proporzionalità inversa capiamo che all'aumentare della forza di un acido (Ka cresce) di conseguenza diminuisce la forza della base coniugata (Kb decresce).
La risposta B, è CORRETTA e la sua individuazione è immediata. Al contrario la risposta C è ERRATA in quanto andrebbe formulata così: quanto più debole è un acido, tanto più forte è la sua base coniugata.
Per valutare le altre risposte dobbiamo ricordare che un acido si definisce forte per Ka>10–1 e debole per Ka<10–4
Analogamente una base si definisce forte per Kb>10–1 e debole per Kb<10–4
Valutiamo la risposta A). Consideriamo due acidi deboli con Ka1=10–5 e Ka2=10–13 (pur avendo Ka molto diversi sono entrambi deboli). Le Kb delle basi coniugate saranno:
Kb1 = Kw/Ka1 = 10–14/10–5 = 10–9 (base debole)
Kb2 = Kw/Ka2 = 10–14/10–13 = 10–1 (base forte)
Con questo esempio possiamo affermare che ad un acido debole si può associare sia una base coniugata debole, sia forte. L'affermazione della risposta A è perciò non sempre vera.
Valutiamo la risposta D). Con un ragionamento simile al precedente possiamo dimostrare che ad una base debole può corrispondere un acido coniugato sia forte che debole.
Valutiamo la risposta E). Con un semplice ragionamento possiamo dimostrare che ad acido forte può corrispondere una base coniugata debole.


