Medicina 2004
Secondo Bronsted e Lowry, l’acido coniugato della base HPO42- è:
L'acido fosforico (ortofosforico) H3PO4 è un acido triprotico e nelle tre deprotonazioni dà origine a tre diversi ioni:
Prima deprotonazione:
H3PO4 → H+ + H2PO4‒ Ione diidrogenofosfato
Seconda deprotonazione:
H2PO4‒ → H+ + HPO42‒ Ione idrogenofosfato
Terza deprotonazione:
HPO4= → H+ + PO43‒ Ione fosfato
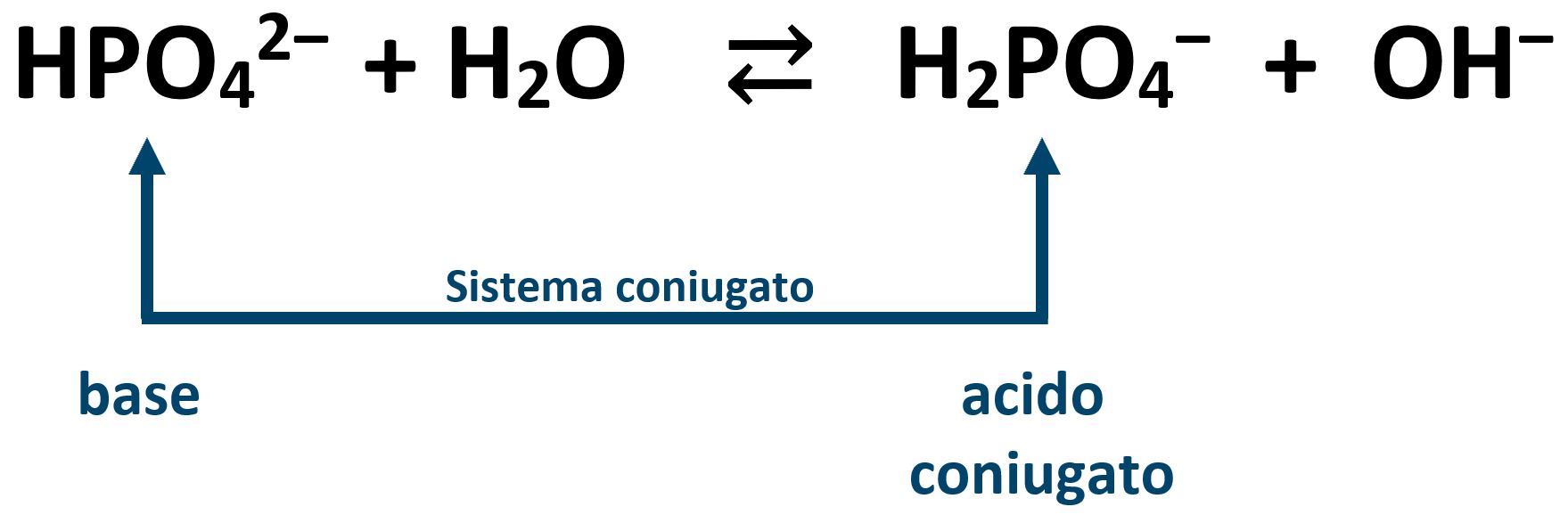
I due ioni di deigrogenazione incompleta H2PO4‒ e HPO42‒ hanno un comportamento anfotero o anfilitico. Lo ione idrogeno fosfato HPO42‒ può spostarsi verso lo ione fosfato deprotonando verso lo ione fosfato PO43‒ con un comportamento acido, oppure può spostarsi verso lo ione diidrogenofosfato H2PO4‒ acquistando un H+ con un comportamento basico.
HPO42‒ + H+ ⇄ H2PO4‒
Lo ione idrogeno fosfato HPO42‒ è la BASE e lo ione diidrogenofosfato è il suo acido coniugato. Risposta A).