p.san 2012
Si consideri la reazione necessaria per neutralizzare 1 litro di soluzione 0,5 M di HCl, ottenendo come prodotto NaCl. Quale affermazione in merito è FALSA?
Dalle informazioni fornite dal quiz risulta chiaro che la soluzione contenente l'acido cloridrico HCl viene neutralizzata dall'idrossido di sodio NaOH. Ne risulta la formazione del sale cloruro di sodio NaCl e gli H+ si saranno neutralizzati tutti con gli OH–; la soluzione sarà di conseguenza neutra a pH=7. Risulta perciò immediatamente evidente che la risposta A) è quella che contiene l'affermazione FALSA che cerchiamo.
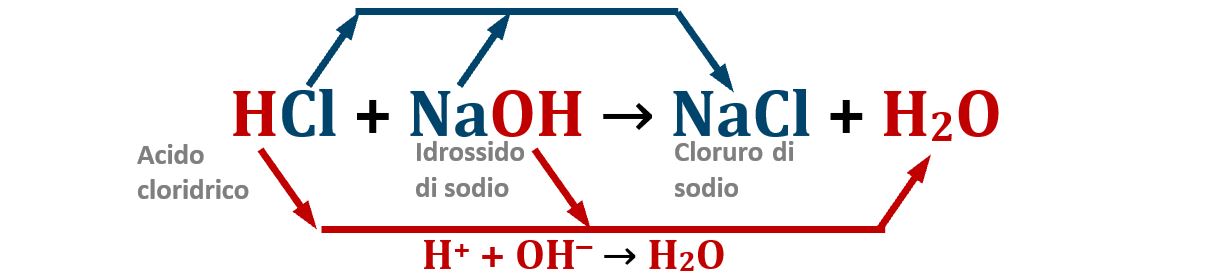 Un calcolo preciso di quanto NaOH sarà necessario si effettua calcolando le moli di HCl presenti; le moli di NaOH necessarie saranno uguali alle moli di HCl.
Un calcolo preciso di quanto NaOH sarà necessario si effettua calcolando le moli di HCl presenti; le moli di NaOH necessarie saranno uguali alle moli di HCl.
nNaOH = nHCl = MHCl · VHCl = 0,5 · 1 = 0,5 mol
Questo valore di moli di NaOH è correttamente ripostato nelle soluzioni B) ed E) che riportano 1 litro di soluzione 0,5M di NaOH.
La soluzione E) riporta anche la concentrazione finale del sale formato che risulta corretta; infatti avremo 0,5 moli di NaCl (derivanti da 0,5 mol di Na+ e 0,5 mol di Cl–) in due litri di soluzione (derivanti dalla somma dei due volumi che concorrono alla soluzione finale). Avremo così MNaCL = 0,5mol / 2L = 0,25 mol/L


