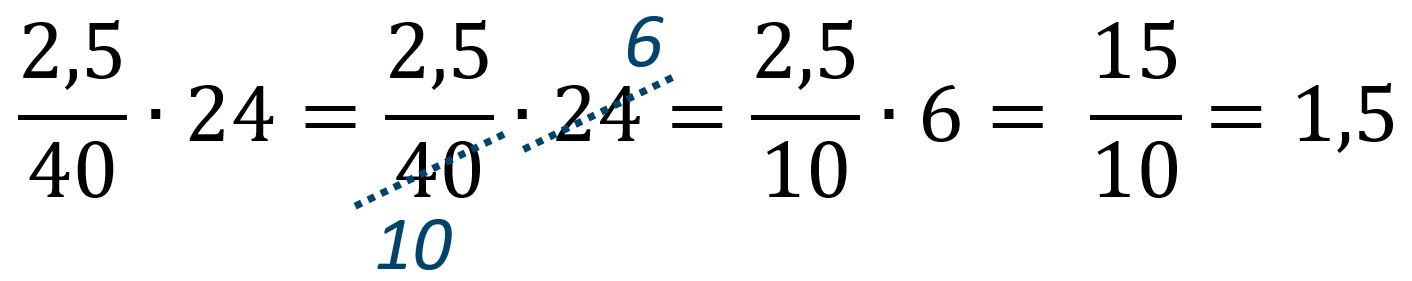Veterinaria 2013
Qual è il volume di idrogeno prodotto quando 2,5 g di calcio reagiscono con un eccesso di acqua?
[Il volume molare del gas, nelle condizioni dell’esperimento, è di 24 litri per mole]
[La massa atomica relativa del calcio è 40]
Il calcio Ca, come tutti gli elementi del primo e del secondo gruppo, reagisce con l'acqua per dare un idrossido con liberazione di idrogeno gassoso. La reazione è
___Ca + ___H2O → ___Ca(OH)2 + ___H2
Dobbiamo bilanciare la reazione. Si procede bilanciando, in ordine, prima il calcio , poi l'idrogeno e infine l'ossigeno.
Bilanciamo il calcio: abbiamo un solo atomo di calcio Ca tra i reagenti e ne consideriamo di conseguenza uno tra i prodotti utilizzando i coefficienti 1 e 1 per Ca e per Ca(OH)2
1 Ca + ___H2O → 1 Ca(OH)2 + ___H2
Bilanciamo l'idrogeno: assumiamo il coefficiente stechiometrico 1 per H2 e abbiamo tra i prodotti 4 atomi di idrogeno (due in Ca(OH)2 e due in H2). Per averne quattro tra i reagenti usiamo il coefficiente 2 per l'acqua
1 Ca + 2 H2O → 1 Ca(OH)2 + 1 H2
Infine l'ossigeno. Osserviamo che l'ossigeno è ben bilanciato perché abbiamo due atomi tra i reagenti in 2H2O e due a destra in Ca(OH)2.
La reazione è ora bilanciata e possiamo individuare i coefficienti stechiometrici:
1 Ca + 2 H2O → 1 Ca(OH)2 + 1 H2
1 : 2 → 1 : 1
I coefficienti stechiometrici esprimono un rapporto tra moli. La quantità del reagente calcio è fornita in grammi e dobbiamo trasformarla in moli, utilizzando il peso atomico (o massa atomica relativa) del calcio che vale 40 g/mol.
nCa= mCa / PACa= = 2,5(g) / 40 (g/mol) = 0,0625 mol
La quantità di prodotto di reazione idrogeno H2 si ottiene dai coefficienti di reazione di calcio e idrogeno
1 → 1
nH2 = nCa = 0,0625 mol
Trasformiamo infine le 0,0625 moli di idrogeno in litri con la conversione indicata nel testo
VH2 = nH2 · 24 = 0,0625 · 24 = 1,5 Litri = 1500 mL
Nota 1: In condizioni standard di 0°C e 1 atm una mole di gas corrisponde a 22,4 Litri. Spesso le conversioni si fanno con questo valore. Nel caso del presente quiz si utilizza il valore 24 perché le condizioni di temperatura e pressione sono diverse.
Nota 2: I calcoli nei test di ammissione vanno svolti senza l'ausilio di una calcolatrice. Per questo motivo si cercano vie veloci di calcolo. Può essere interessante il suggerimento di non effettuare subito il calcolo 2,5/40=0,0625, ma lasciare la frazione 2,5/40 per il calcolo successivo del volume di idrogeno. In questo modo avremo: