Veterinaria 2011
Quale tra le seguenti configurazioni elettroniche è corretta?
Consideriamo le regole di riempimento progressivo degli orbitali secondo il principio dell'aufbau.
Riportiamo due schemi diversi che indicano il corretto procedimento nell'ordine di riempimento.
Per studiare il principio dell'aufbau puoi seguire questo link.
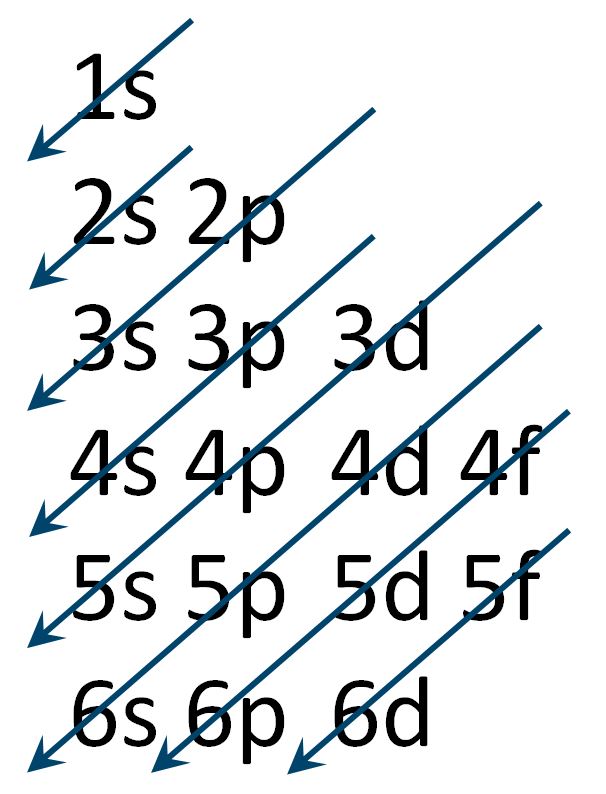
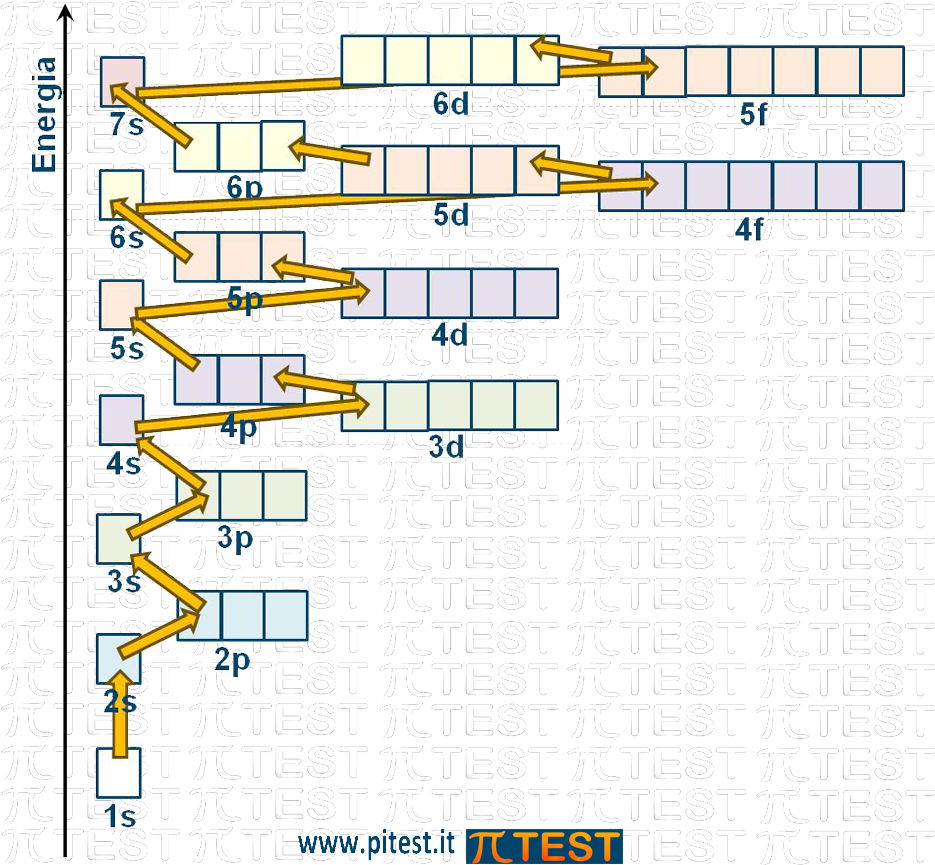
Analizziamo le risposte del quiz:
A) 1s2 2s2 2p8 3s2
Nei tre orbitali p del secondo livello (2p) possono essere presenti al massimo 6 elettroni. In ciascun orbitale infatti possono esserci al massimo due elettroni con spin opposto, come afferma il principio di esclusione di Pauli. Ce ne sono invece 8. Risposta errata.
B) 1s22s22p62d4
Nel secondo livello esiste soltanto un orbitale s e tre orbitali p. Non ci sono orbitali di tipo d. Risposta errata.
C) 1s22s22p63s23p64s2
La configurazione è ben scritta. Si tratta della configurazione del calcio Ca, il ventesimo elemento della tavola periodica degli elementi.
D) 1s22s22p63s23p7
Nei tre orbitali p del terzo livello (3p) possono essere presenti al massimo 6 elettroni. In ciascun orbitale infatti possono esserci al massimo due elettroni con spin opposto, come afferma il principio di esclusione di Pauli. Ce ne sono invece 7. Risposta errata.
E) 1s22s22p63s43p2
Nell'orbitale s del terzo livello (3s) possono essere presenti al massimo 2 elettroni. In ciascun orbitale infatti possono esserci al massimo due elettroni con spin opposto, come afferma il principio di esclusione di Pauli. Ce ne sono invece 4. Risposta errata.


