Medicina 2007
Nella tavola periodica degli elementi l'energia di ionizzazione dall'alto in basso lungo un gruppo:

Quando viene strappato un elettrone e‒ ad un atomo occorre una certa energia. Facciamo riferimento ad un generico atomo X che si trova allo stato gassoso e che viene scritto X(g)
X(g) + energia ➞ X(g)+ + e‒
Questa energia è detta energia di prima ionizzazione.
Definizione: L'energia di ionizzazione di un atomo è l'energia richiesta per allontanare un elettrone dall’atomo in forma gassosa.
In generale l’atomo con un elettrone in meno ha una dimensione minore rispetto all’atomo neutro in quanto la nuvola elettronica diminuita di una carica negativa è sbilanciata rispetto alle cariche positive (protoni) nel nucleo che risultano maggiori in numero e attraggono maggiormente gli elettroni presenti.
Spostandoci sulla tavola periodica degli elementi l’andamento generale dei valori di energia di prima ionizzazione segue un andamento esattamente al contrario dell’andamento dei valori di raggio atomico. Decresce verso il basso lungo i gruppi e aumenta verso destra lungo i periodi.
Analisi dettagliata
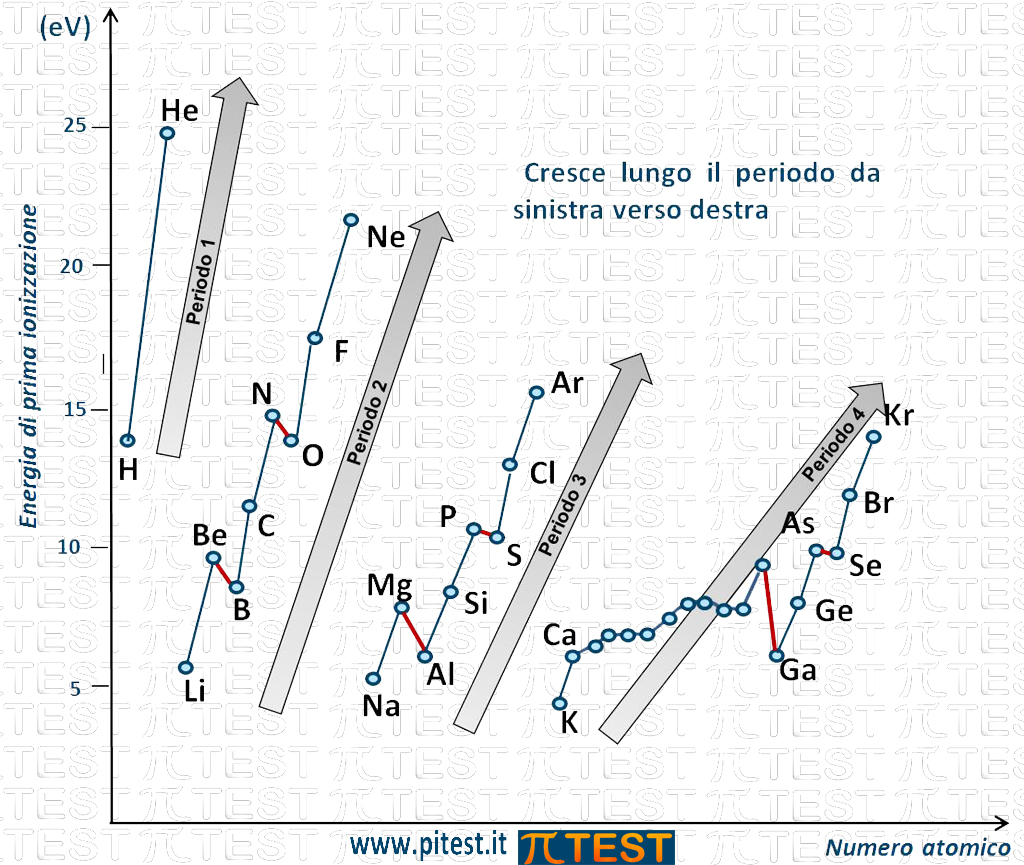
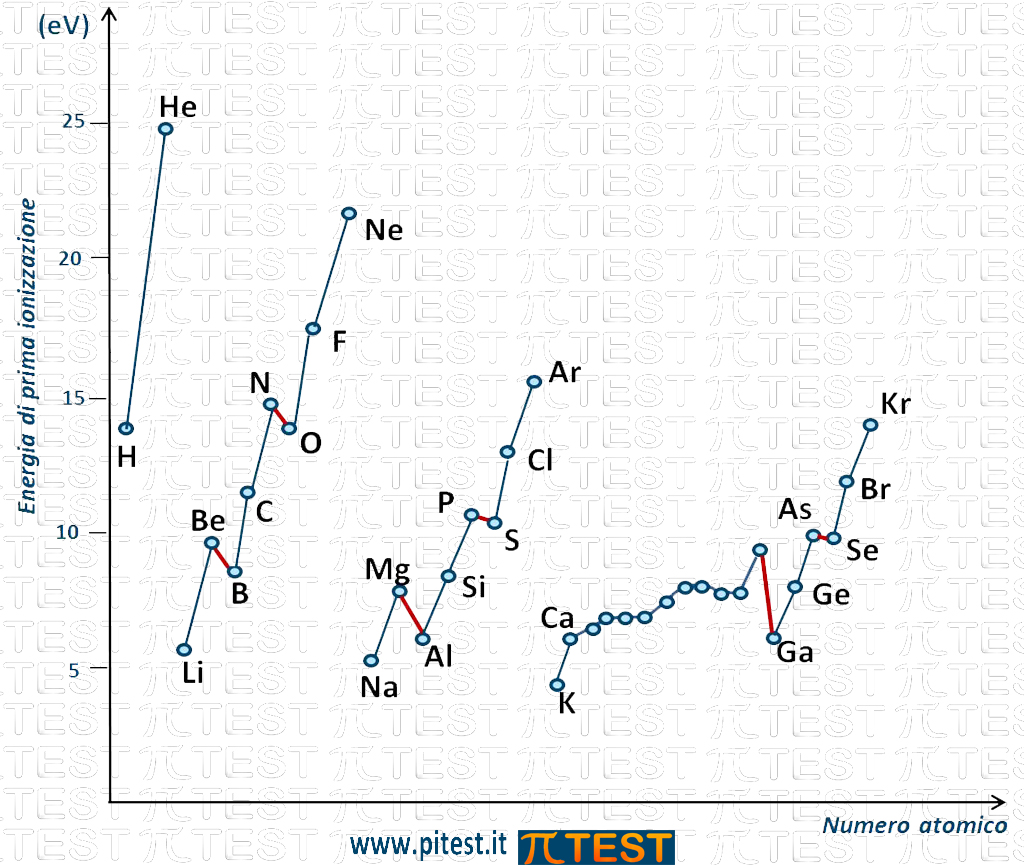
Se andiamo più in dettaglio, l’andamento del valore dell’energia di prima ionizzazione è rappresentato in figura (sono indicati gli elementi dei primi quatto periodi; per gli altri non rappresentati l’andamento è simile):
Andamento lungo i gruppi
Possiamo osservare che lungo un gruppo dall’alto verso il basso l’energia di prima ionizzazione diminuisce come indicato nella seguente figura dalle linee che seguono gli elementi di uno stesso periodo.
La prima linea in alto passa per i punti che rappresentano le energie di prima ionizzazione degli elementi del gruppo VIIIA, i gas nobili (He, Ne, Ar, Kr, …). È una linea decrescente che indica il fatto che, passando dal gas nobile più in alto nella tavola periodica, l’elio He, andando verso i gas nobili sottostanti, l’energia di prima ionizzazione va decrescendo.
La stessa cosa accade per il gruppo VIIA degli alogeni con una linea decrescente che parte dall’alogeno più in alto nella tavola periodica, il fluoro F, e prosegue scendendo verso il cloro, il bromo , ecc.
E così via per tutti i gruppi. In figura sono rappresentate le linee che riguardano i gruppi VIA, IIA e IA.
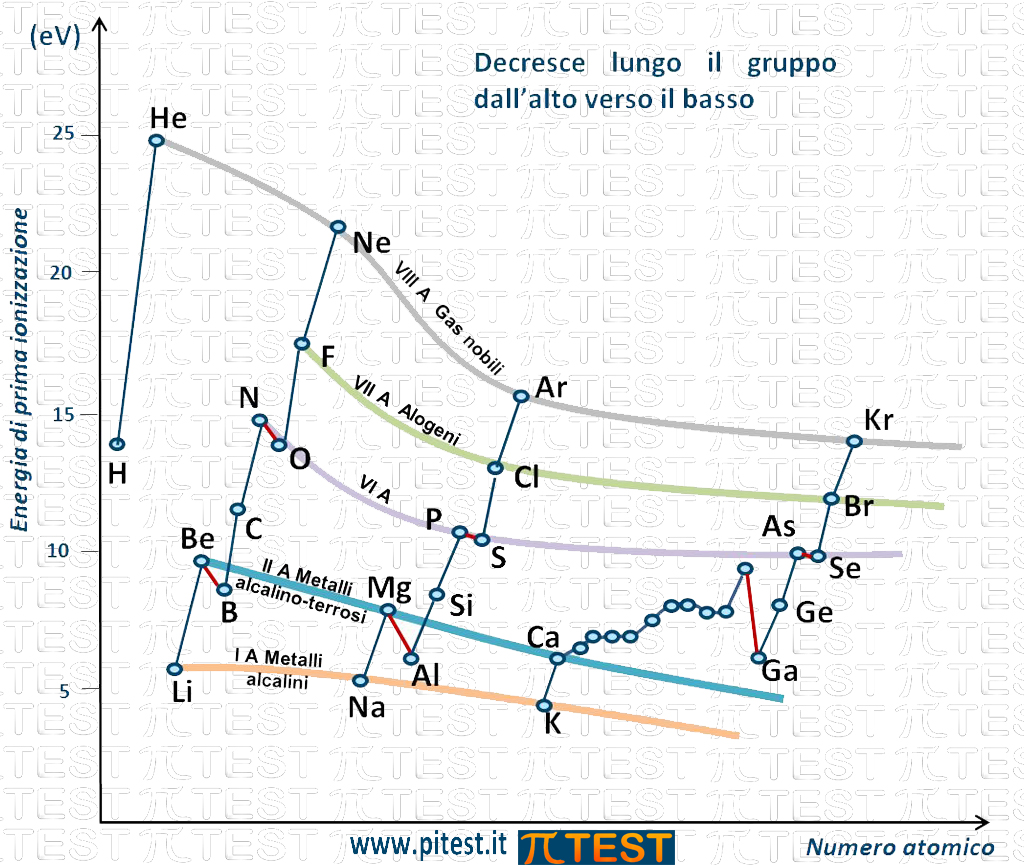
Il fenomeno si interpreta con il fatto che lungo un gruppo il guscio elettronico esterno è simile e cambia solo la dimensione del guscio che è più grande scendendo verso il basso. Ad esempio nel primo gruppo dei metalli alcalini la caratteristica è quella di avere un solo elettrone nell'orbitale s del guscio più esterno (guscio di valenza). Quello che cambia passando dal litio Li al sodio Na è la dimensione dell’orbitale s. Nel litio si tratta dell’orbitale 2s e nel sodio si tratta dell’orbitale 3s. Continuando abbiamo il potassio K con un solo elettrone nell'orbitale 4s e così via. Quando l’elettrone che verrà strappato all'atomo si trova in un orbitale più grande e più lontano dal nucleo il lavoro necessario è minore e di conseguenza è minore l’energia di prima ionizzazione.
Andamento lungo i periodi
Possiamo osservare che lungo un periodo sulla tavola periodica da sinistra verso destra l’energia di prima ionizzazione aumenta come indicato nella figura dalle frecce che seguono gli elementi di uno stesso periodo: