4.10 I legami intermolecolari
QUIZ 13
Medicina 2014
Quale tipo di forze intermolecolari esiste nel tetraclorometano?
Il tetraclorometano CCl4 possiede una simmetria spaziale tetraedrica così come il metano.
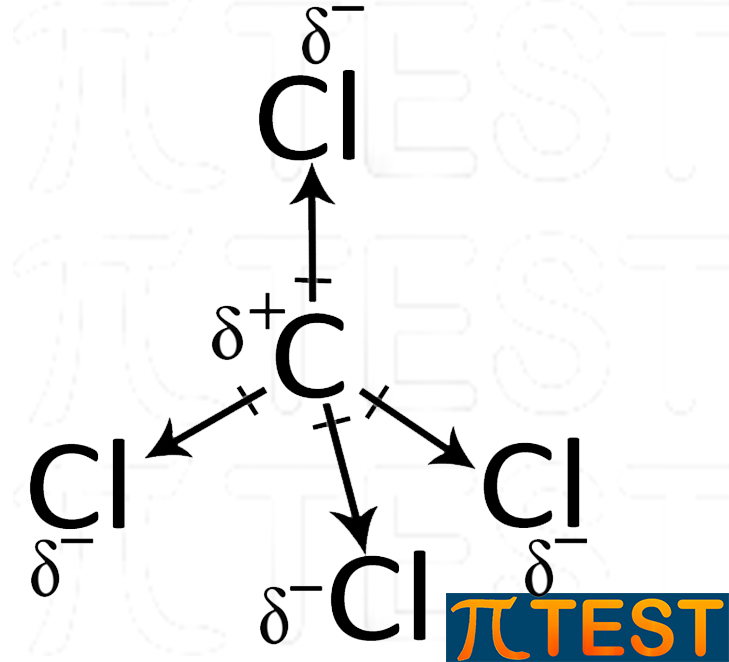
i quattro legami carbonio-cloro sono polarizzati e sono rappresentabili come quattro vettori-dipolo diretti verso i vertici di un tetraedro regolare. Grazie a questa simmetria spaziale i quattro dipoli si annullano rendendo apolare la molecola.
Come ogni altra molecola apolare, il tetraclorometano presenta forze intermolecolari solamente di tipo "forze di London". Secondo London le molecole apolari formano a volte per brevi istanti un dipolo a causa della distribuzione degli elettroni che, anche se mediamente è uniforme e senza polarità, per un istante possono trovarsi sbilanciati in eccesso da una parte della molecola formando un polo negativo temporaneo; dalla parte opposta rimane un polo positivo. Nel complesso si è formato un dipolo temporaneo o istantaneo (che dura un solo istante). Questo dipolo istantaneo crea un campo elettrico e induce nelle nuvole elettroniche delle molecole adiacenti un altro dipolo (dipolo indotto). Tra dipolo istantaneo e dipolo indotto si verifica una attrazione che pur breve nel tempo è sempre una attrazione.
QUIZ sui Legami Intermolecolari |
|||
|---|---|---|---|
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito


