4.10 I legami intermolecolari
QUIZ 09
Veterinaria 2009
Il legame idrogeno:
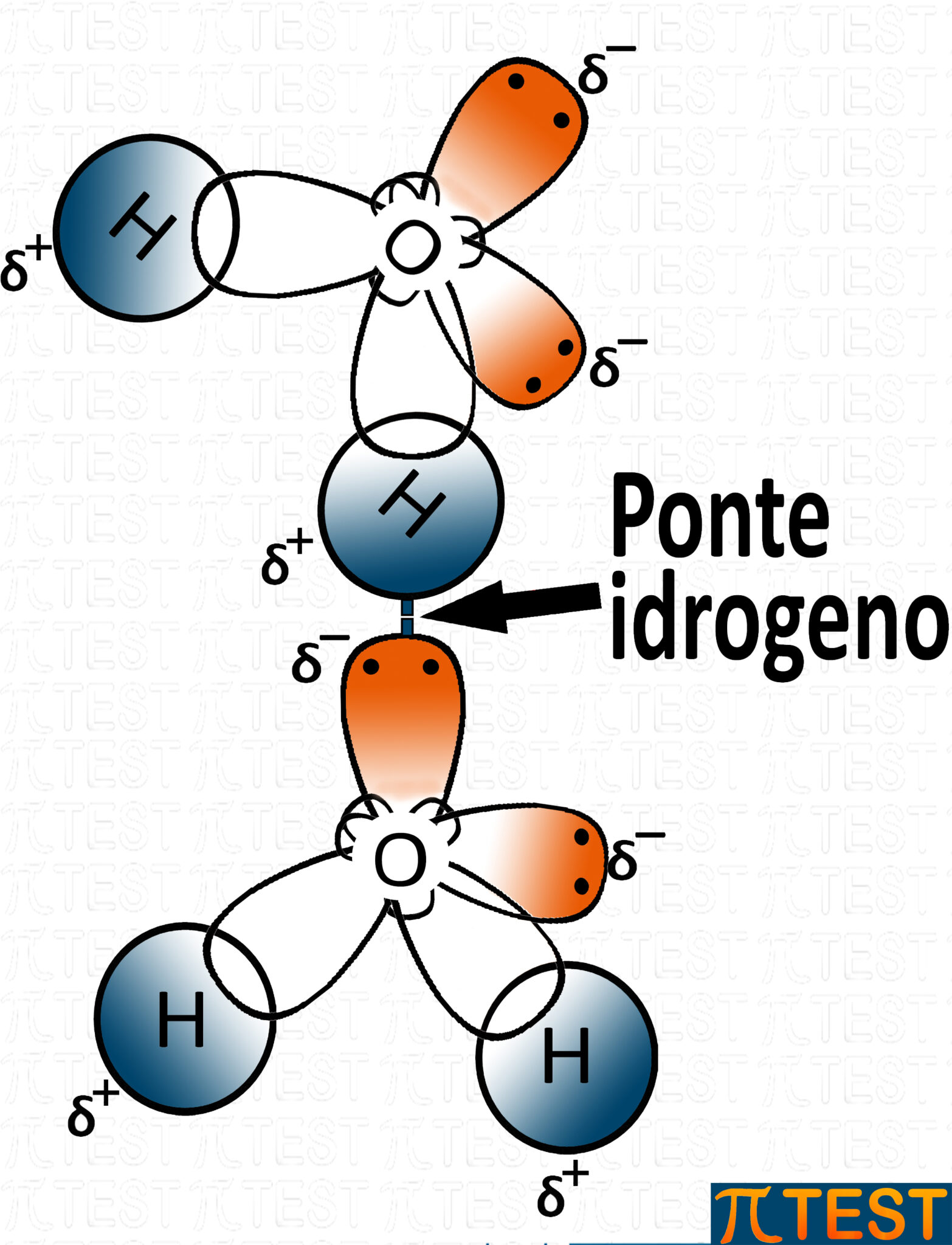
Quando all’interno di un composto troviamo un atomo di idrogeno H legato ad un atomo molto elettronegativo (azoto N, ossigeno O e fluoro F), si forma un legame intermolecolare molto forte tra quest’atomo di idrogeno di una molecola con l’atomo elettronegativo (N, O o F) di un’altra molecola.
I composti che si utilizzano come esempi tipici di legame a idrogeno sono l’ammoniaca NH3, l’acqua H2O e l’acido fluoridrico HF.
Oltre al fatto che i legami H-O, H-N e H-F sono molto polari si aggiunge anche che azoto, ossigeno e fluoro possiedono doppietti elettronici liberi (orbitali occupati da due elettroni e non coinvolti in legami covalenti) che contribuiscono a creare un polo fortemente negativo δ−; di contro sugli atomi di idrogeno si forma un polo positivo δ+.
Il legame ad idrogeno o ponte idrogeno si forma quando un atomo di idrogeno è attratto elettrostaticamente dall’atomo elettronegativo di una molecola accanto.
Tra tutti i legami intermolecolari è il più forte.
QUIZ sui Legami Intermolecolari |
|||
|---|---|---|---|
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito


