4.10 I legami intermolecolari
QUIZ 04
Odontoiatria 2000
Il legame a ponte di idrogeno:
Il legame idrogeno, detto anche ponte idrogeno, è un legame intermolecolare (tra due molecole).
NON è perciò un legame covalente (legame interno alla molecola).
Come tutti i legami intermolecolari NON è un legame classificabile come "forte".
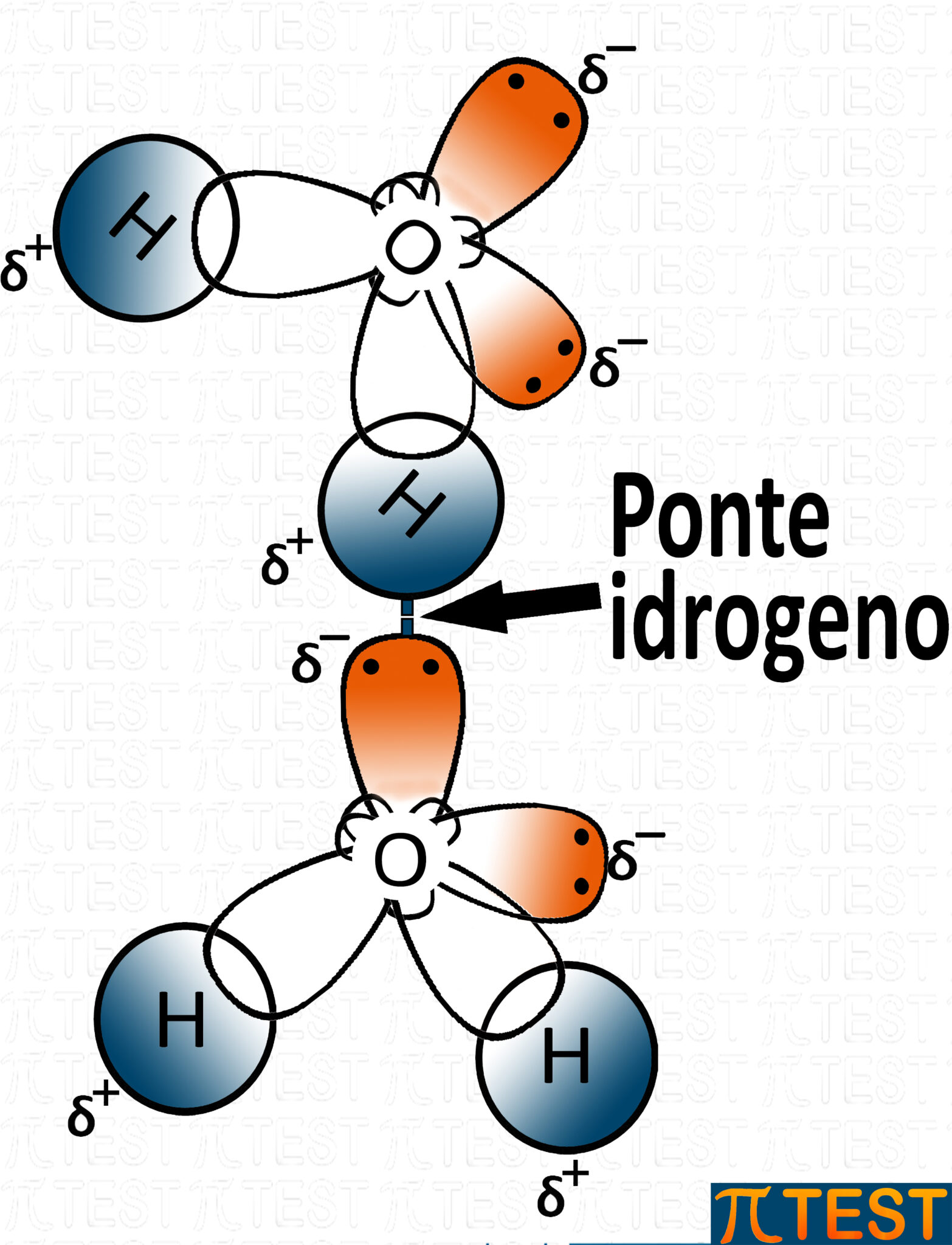
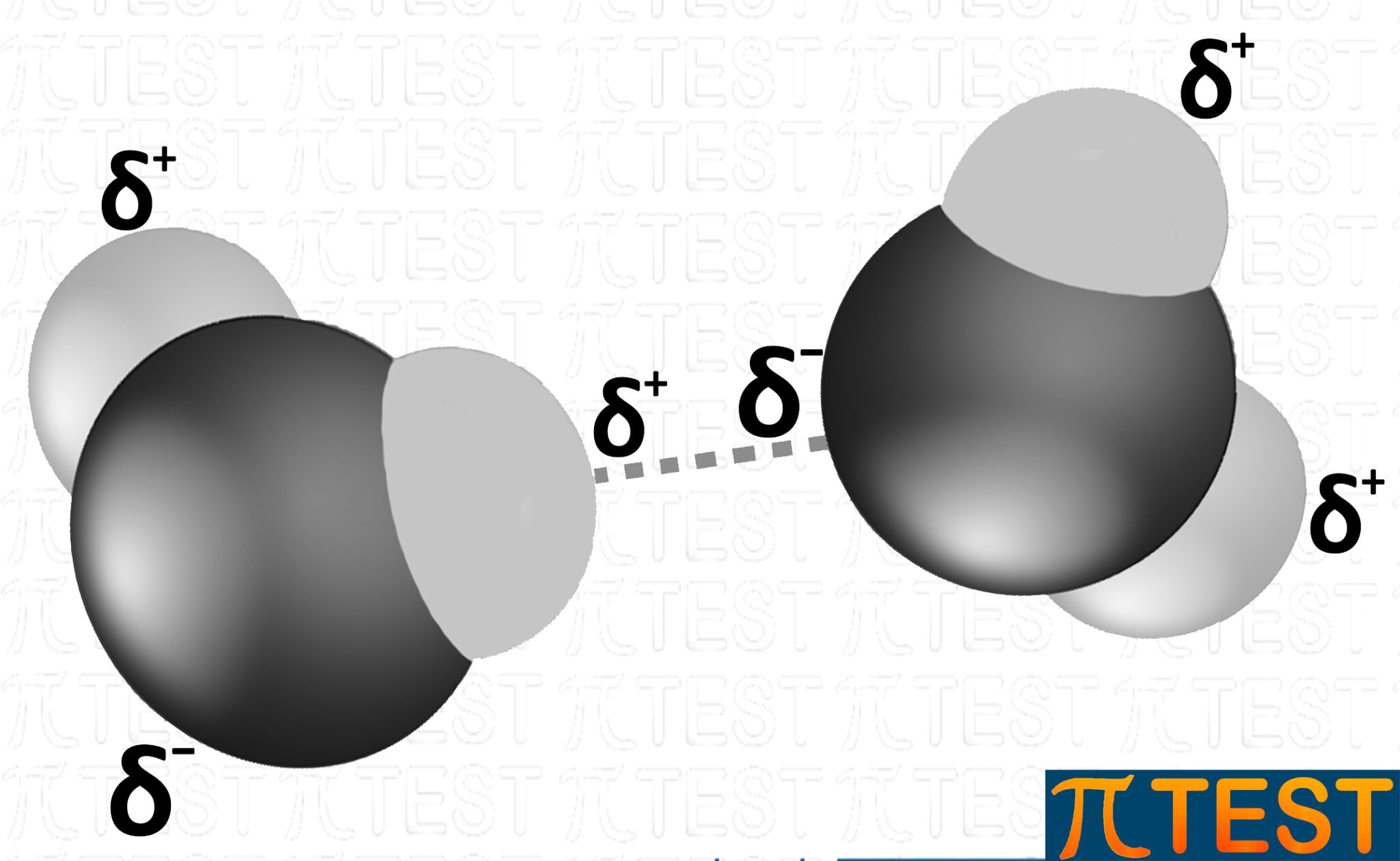
L'immagine qui sopra rappresenta un legame idrogeno tra due molecole d'acqua.
Possiamo rappresentarlo anche con la seguente immagine.
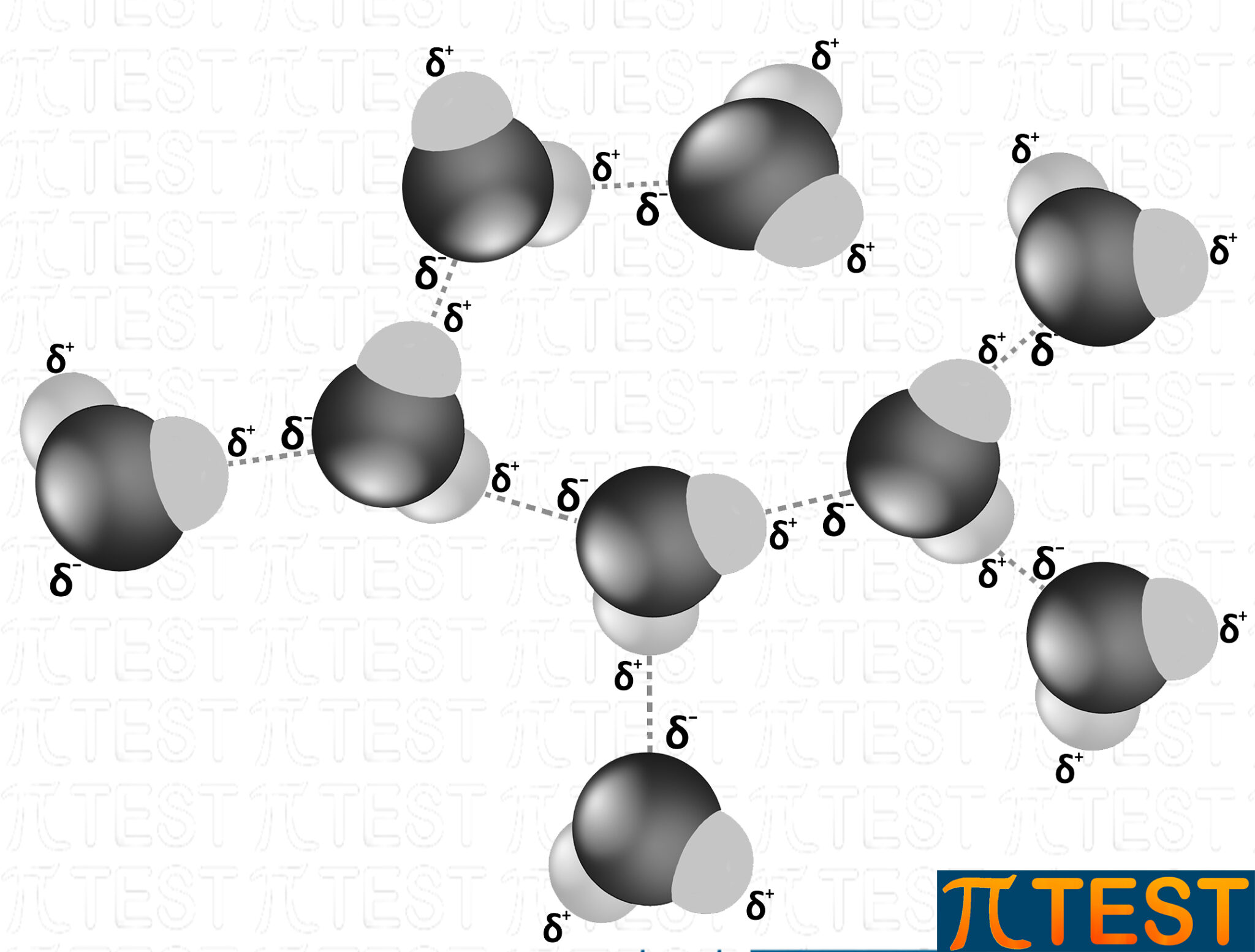
Tutte le molecole d’acqua sono collegate tramite ponti idrogeno.
Nell’acqua il legame a idrogeno si forma sia nello stato liquido che nello stato solido.
Il legame ad idrogeno nell’acqua è responsabile di alcuni comportamenti particolari che caratterizzano l’acqua rispetto ad altre sostanze:
Diminuzione di densità del solido rispetto al liquido. Nella fase solida le molecole d’acqua assumono una posizione l’una rispetto all’altra tale da rendere le posizioni “comode” che rispettano sia la presenza di ponti idrogeno, sia l’angolo proprio di 107,5° della molecola d’acqua. Questo porta la formazione di strutture esagonali con zone completamente vuote che alleggeriscono la struttura e diminuiscono la densità. Da tale diminuzione di densità deriva il galleggiamento del ghiaccio sull’acqua.
| acqua | ghiaccio |
 |
 |
Densità dell'acqua liquida =1000 kg/m3 = 1 g/cm3 |
Densità dell'acqua solida (ghiaccio) =900 kg/m3 = 0,9 g/cm3 |
Formazione del fiocco di neve che con la sua bellissima geometria è dovuto ai legami ad idrogeno tra molecole d’acqua che passano dallo stato gassoso a quello solido (brinamento) permettendo alle molecole di prendere la posizione più comoda che rispetta l’angolo proprio della molecola d’acqua di 107,5°.
Il legame a idrogeno è responsabile di una forte coesione intermolecolare che causa un punto di ebollizione molto alto, di 100°C. Altre molecole polari anche più pesanti hanno un punto di ebollizione molto più basso per il solo fatto di non avere legami ad idrogeno. Ad esempio l’acido solfidrico H2S presenta una geometria identica (ibridazione sp3) ma non forma legami a idrogeno e per questo motivo il suo punto di ebollizione è di -140°C.
QUIZ sui Legami Intermolecolari |
|||
|---|---|---|---|
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito


