Odontoiatria 2009
Indica quale è la pressione osmotica a 0°C di una soluzione di urea allo 0,5 % p/V sapendo che il P.M. dell’urea è uguale a 60:
Questo è uno dei rarissimi quiz mai usciti come quiz ufficiali nei quali dobbiamo effettuare calcoli delle proprietà colligative.
La pressione osmotica Π è espressa come:
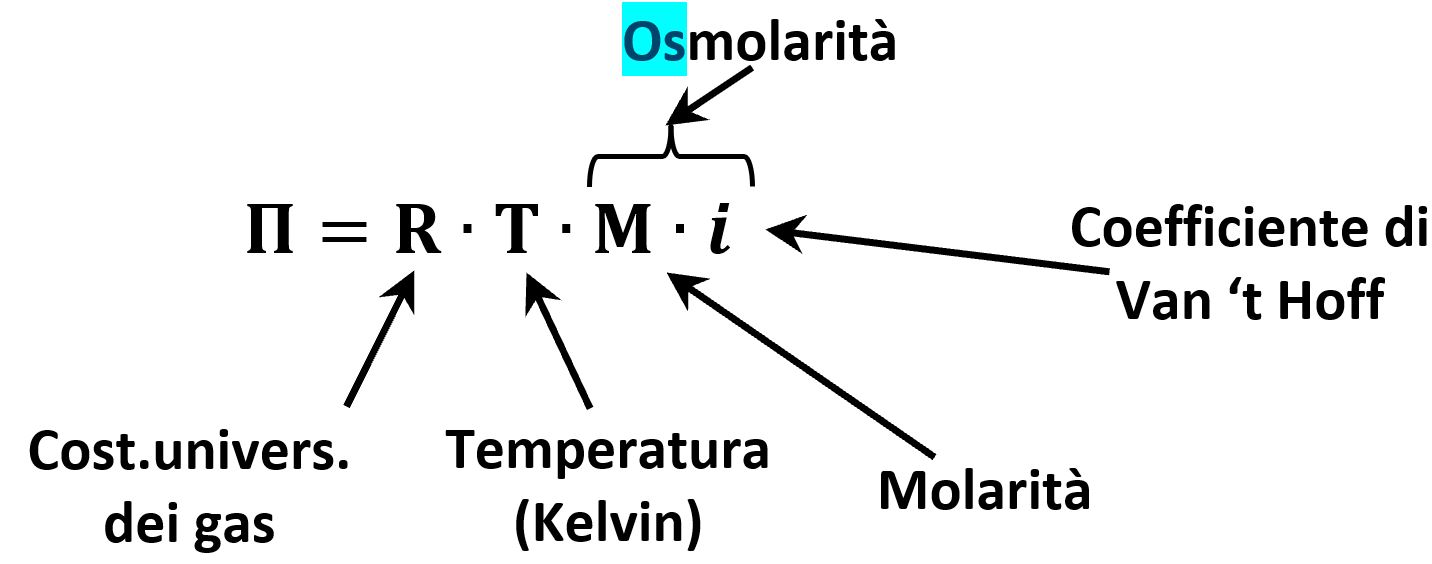
Consideriamo 1 litro di soluzione nel quale possiamo sapere la quantità in massa di urea disciolta a partire dalla sua concentrazione di 0,5 % p/V che corrisponde a 0,5 grammi in 100 mL di soluzione ovvero a 5 grammi in 1 L di soluzione. Dalla massa disciolta in 1 L possiamo ricavare il numero n di moli disciolte utilizzando il peso molecolare:
n = m/PM = 5(g) / 60 (g/mol) = 0,0833 mol
La concentrazione molare di questo litro di soluzione sarà perciò
M = n/V = 0,0833 mol/1 L = 0,0833 mol/L
il valore della costante universale dei gas vale R = 0,082 (L·atm)/(mol·K) (1)
La temperatura di 0°C corrisponde a 273K.
il coefficiente di Van't Hoff i vale 1 perché l'urea non dà luogo a dissociazioni.
Il calcolo della pressione osmotica porta a :
Π = R · T · M · i =
= 0,082 · 273 · 0,0833 · 1 = 1,87 atm
Nota (1)
Per i valori della costante universale dei gas R abiamo:
0,082 (L·atm)/(mol·K)
8,31 (J)/(mol·K)
Scegliamo il primo dei due valori per omogeneità di unità di misura utilizzate in quanto abbiamo i volumi espressi in litri e le pressioni in atmosfere. Se volessimo utilizzare i secondo valore dovremmo utilizzare le unità di misura del Sistema Internazionale (volumi in metri cubi e pressioni in pascal)


