Veterinaria 2004
Una sola delle seguenti affermazioni a proposito del legame covalente NON è corretta. Quale?
valutiamo le risposte:
A) Non è direzionale (affermazione NON corretta)
"direzionale" significa "essere in grado di individuare una direzione. Il legame covalente è direzionale perché in questo tipo di legame i due atomi convolti risultano collegati tra di loro in modo da fornire una ben precisa direzione indicata dalla linea che collega i due atomi nello spazio. Il legame ionico invece non è direzionale perché i cationi (atomi carichi positivamente) e gli anioni (atomi carichi negativamente) sono disposti secondo un reticolo cristallino nel quale non si individua una precisa direzione. La risposta A) riporta pertanto l'affermazione NON corretta che cerchiamo.
B) Può essere polarizzato o non polarizzato (affermazione corretta)
Gli elettroni dei gusci esterni di due atomi coinvolti in un legame covalente sono distribuiti in uno spazio che avvolge i due atomi. Quando i due atomi sono uguali come ad esempio in O2, N2, H2, allora diciamo che il legame covalente è puro o omopolare. Quando invece i due atomi sono diversi ed hanno quindi una differente elettronegatività, allora il guscio elettronico è spostato verso l’atomo più elettronegativo ed avremo un legame covalente polarizzato. Nel legame polare abbiamo la presenza di due poli, uno negativo in corrispondenza dell’atomo più elettronegativo, e l’altro positivo.
C) Può essere semplice, doppio o triplo (affermazione corretta)
Quando due atomi formano un solo legame, sarà sempre un formato da un orbitale σ.
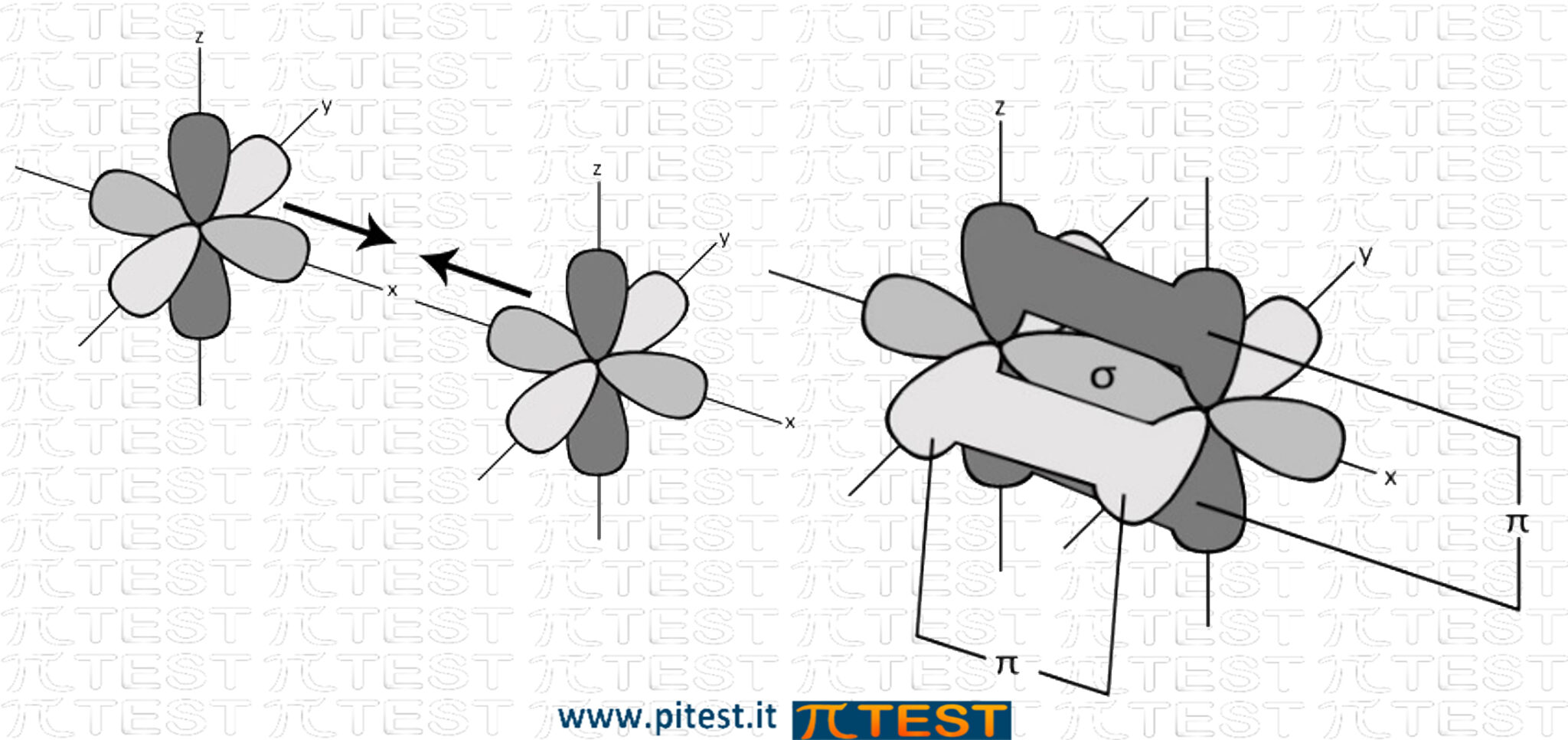
Se invece formeranno un doppio legame , sarà formato da un orbitale ed un π.
Possiamo avere anche un triplo legame formato da un orbitale σ e due π.
Al crescere del numero di legami si parla anche di “ordine di legame”.
Ordine di legame |
Legame singolo |
Orbitali coinvolti |
un orbitale σ |
Esempio: HF (acido fluoridrico) 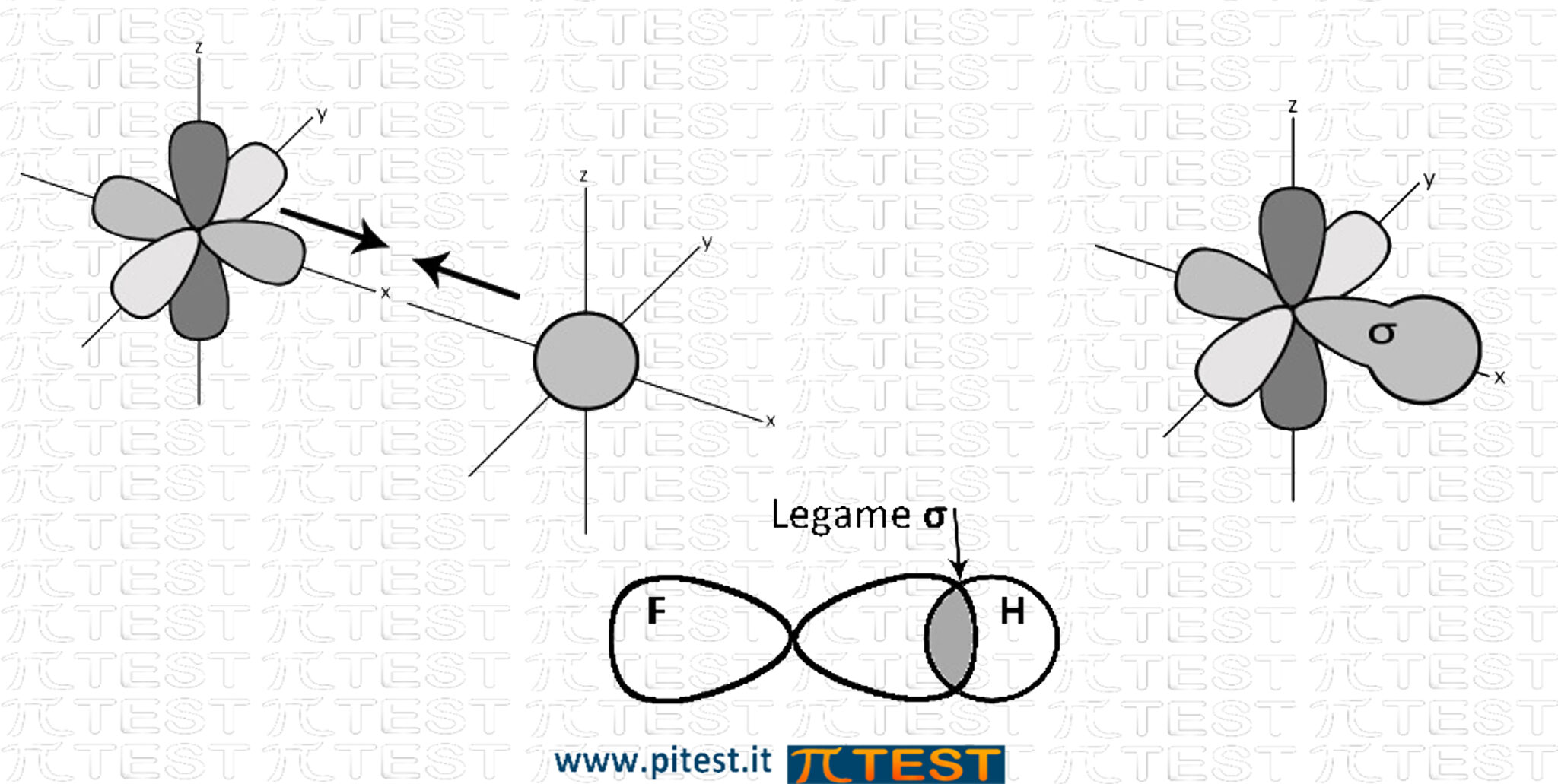 |
|
Ordine di legame |
Legame doppio |
Orbitali coinvolti |
un orbitale σ e un π |
Esempio: O2 O=O (Ossigeno gassoso) 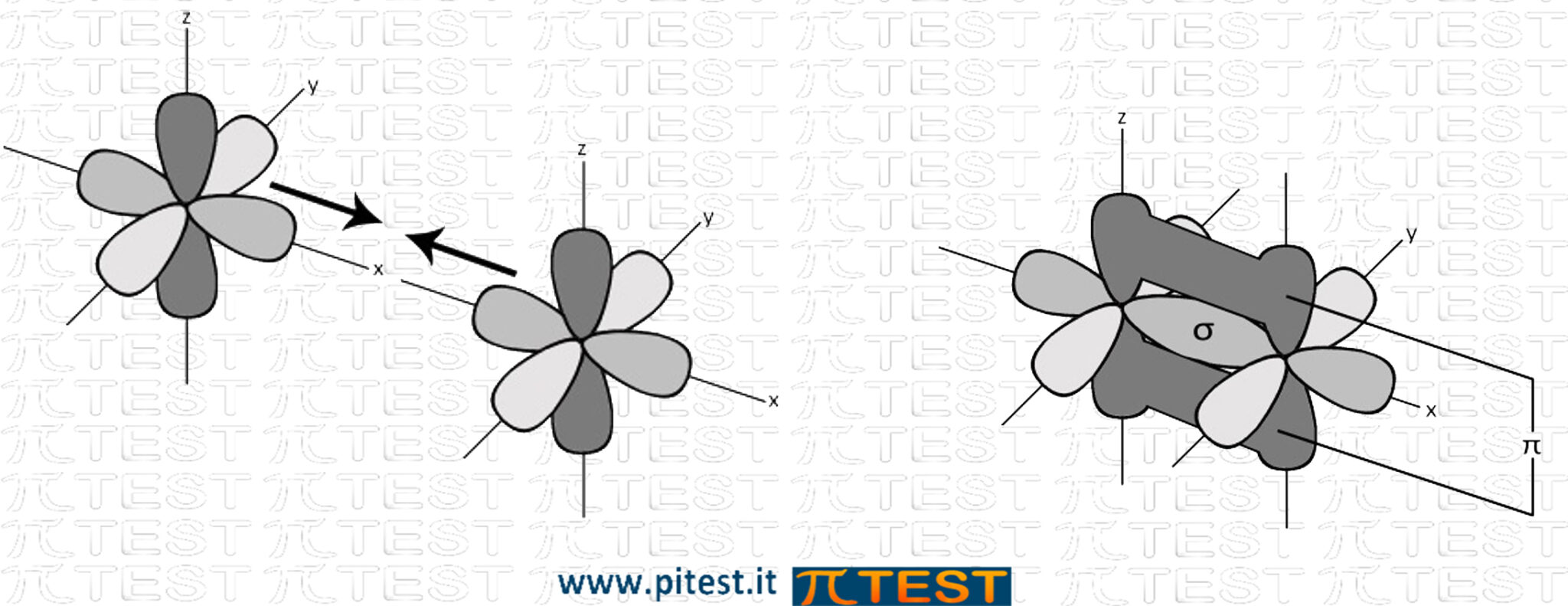 |
|
Ordine di legame |
Legame triplo |
Orbitali coinvolti |
un orbitale σ e due π |
Esempio: N2 N≡N (Azoto gassoso) |
|
D) Si instaura tra elementi con piccole differenze di elettronegatività (affermazione corretta)
Quando la differenza di elettronegatività tra i due atomi coinvolti nella formazione di un legame è inferiore al valore 1,7, si forma un orbitale molecolare.
E) È presente nelle molecole degli alcani (affermazione corretta)
Gli alcani sono idrocarburi, composti chimici formati da carbonio e idrogeno. Tutti i legami presenti sono legami covalenti.