Veterinaria 2015
L’ammoniaca (NH3) ha un punto di ebollizione pari a –33 °C. La fosfina (PH3) ha invece un punto di ebollizione pari a –88 °C. Quale delle seguenti affermazioni spiega perché hanno punti di ebollizione così differenti?
L'ammoniaca e la fosfina sono molecole simili dal punto di vista della spazialità. Sono formate da un atomo rispettivamente di azoto N e di fosforo P ibridato sp3.
ammoniaca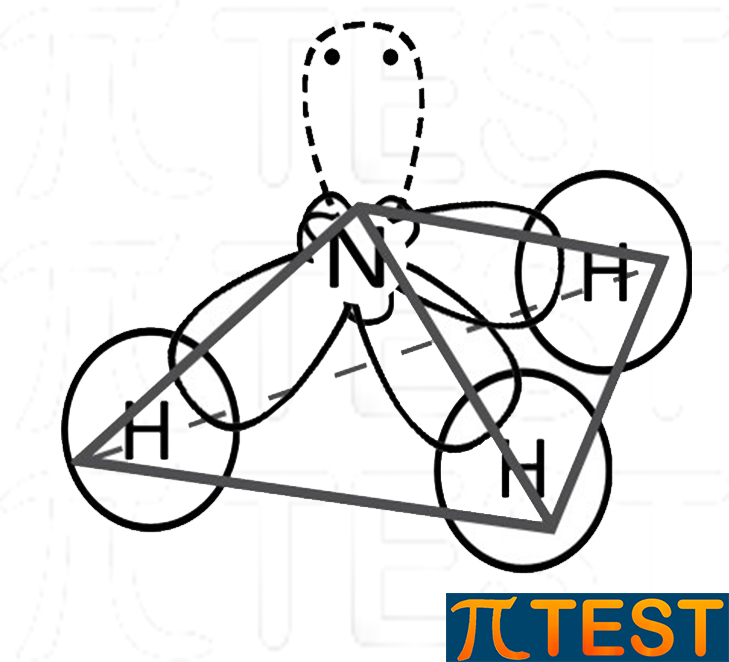 |
fosfina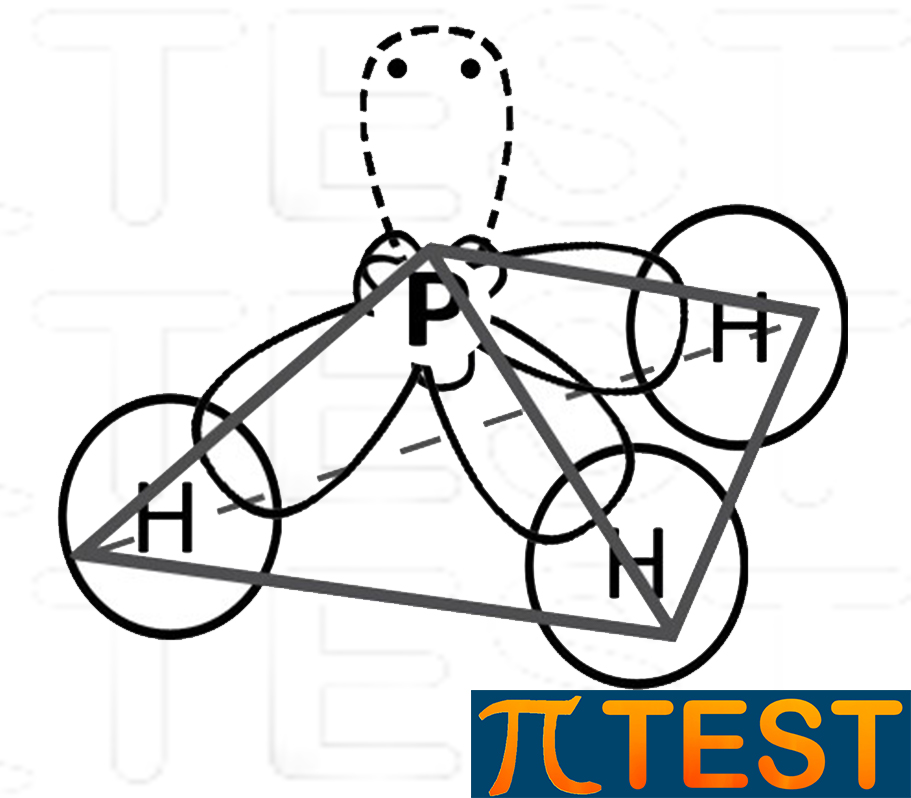 |
Nell'ammoniaca si formano legami intermolecolari a ponte idrogeno tra un atomo di idrogeno e l'atomo di azoto di una molecola contigua. I legami intermolecolari a ponte idrogeno sono i legami intermolecolari più forti.
La stessa cosa non accade invece nella fosfina nella quale NON si formano legami a ponte idrogeno.
L'ammoniaca, con forze intermolecolari più elevate, possiede un più alto punto di ebollizione.
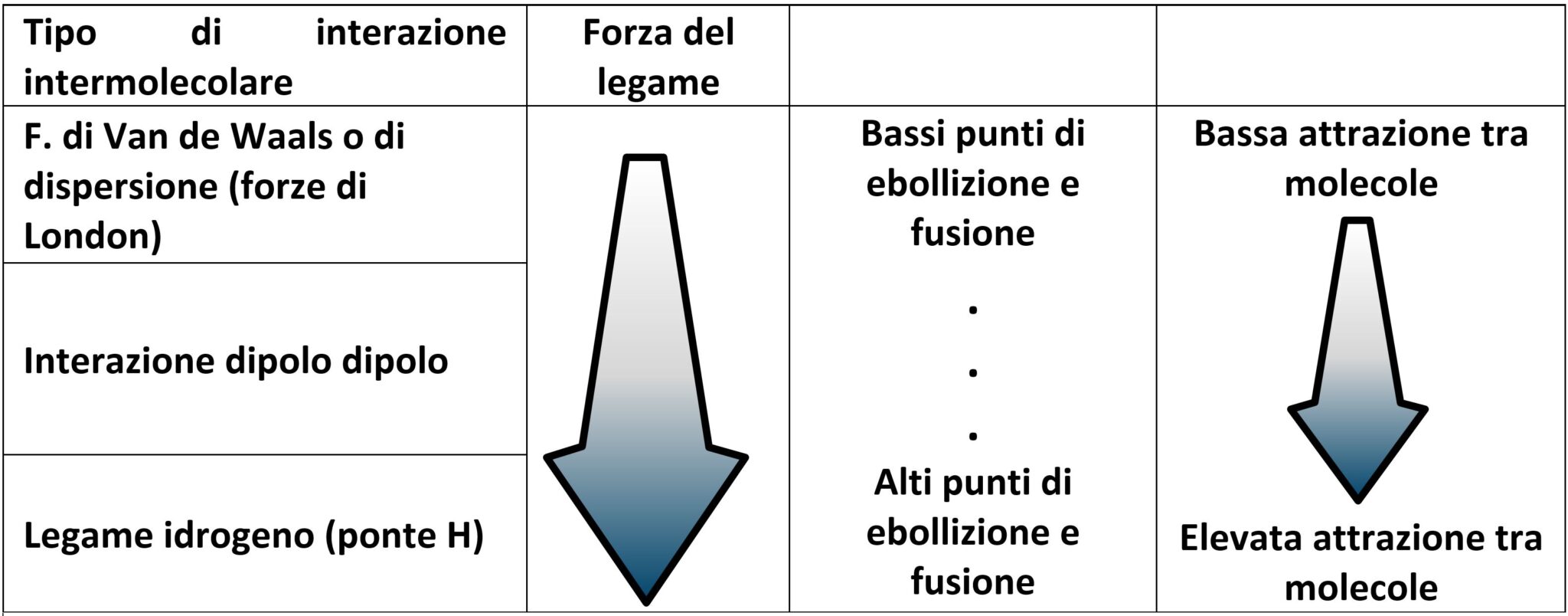
Ricordiamo nella seguente tabella i differenti tipi di forze intermolecolari e le relative forze: