Odontoiatria 2005
L’elettronegatività è:
In una molecola parliamo di elettroni condivisi intendendo gli elettroni coinvolti nei legami chimici. Li chiamiamo anche elettroni di valenza.
Questi elettroni sono distribuiti tra i due atomi coinvolti nel legame chimico. I due atomi li attirano a sé ciascuno con una certa forza. A questa capacità di attrarre gli elettroni di valenza si associa la grandezza elettronegatività.
L'elettronegatività non si può misurare direttamente e deve essere determinata a partire da altre proprietà atomiche o molecolari. Si utilizza il metodo di calcolo di Pauling.
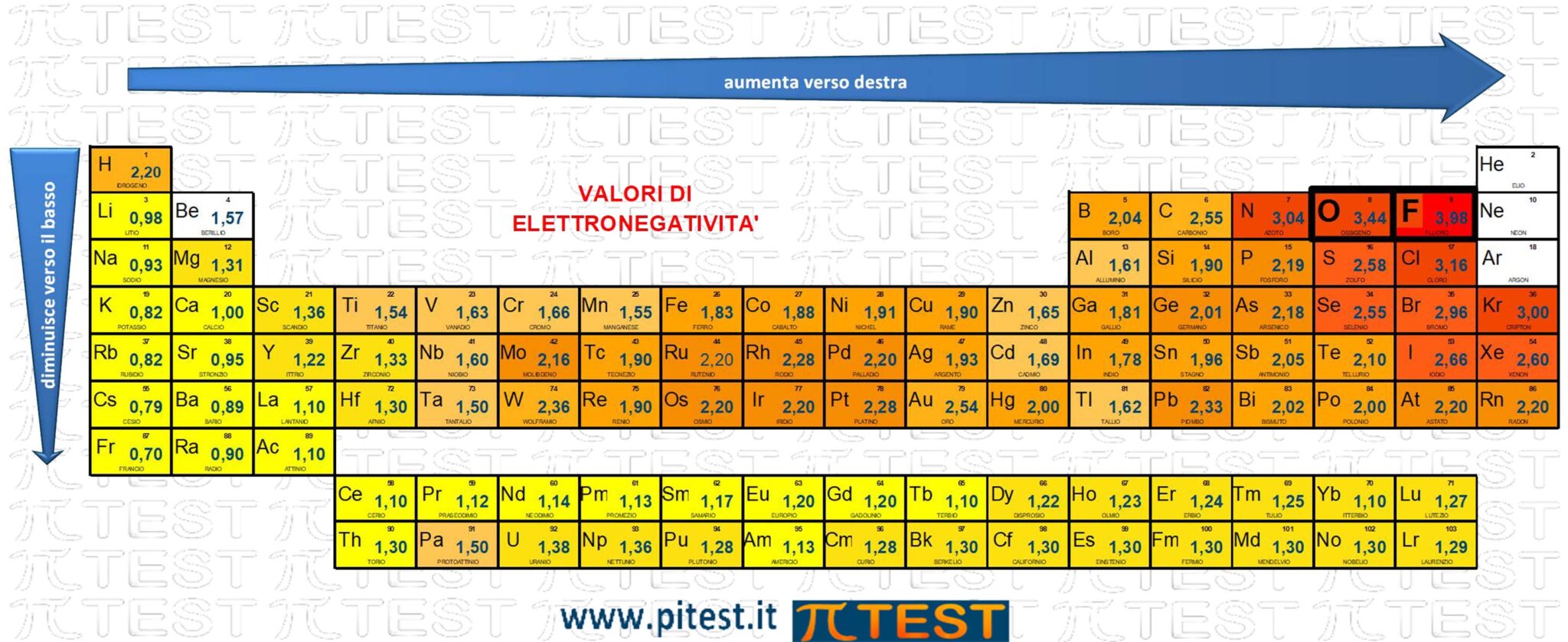
Definizione: L'elettronegatività è una proprietà chimica che descrive la tendenza di un atomo ad attrarre verso di sé elettroni condivisi.
L'elettronegatività decresce verso il basso lungo i gruppi e aumenta verso destra lungo i periodi.
In base alla differenza di elettronegatività tra i due atomi coinvolti in un legame chimico si determina la natura del legame chimico stesso (covalente o ionico) e si valuta anche la polarità del legame.
Nelle risposte del quiz troviamo confronti tra diversi elementi.
A) è minore nell'ossigeno che nello zolfo - ERRATO
Ossigeno O e zolfo S appartengono al sesto gruppo. L'ossigeno si trova più in alto ed ha maggiore elettronegatività

B) è maggiore nel Potassio che nel Litio - ERRATO
Litio Li e potassio K appartengono al primo gruppo. Il potassio si trova più in basso ed ha minore elettronegatività

C) è maggiore nel Fosforo che nell’Azoto - ERRATO
Fosforo P e azoto N appartengono al quinto gruppo. Il fosforo si trova più in basso ed ha minore elettronegatività.

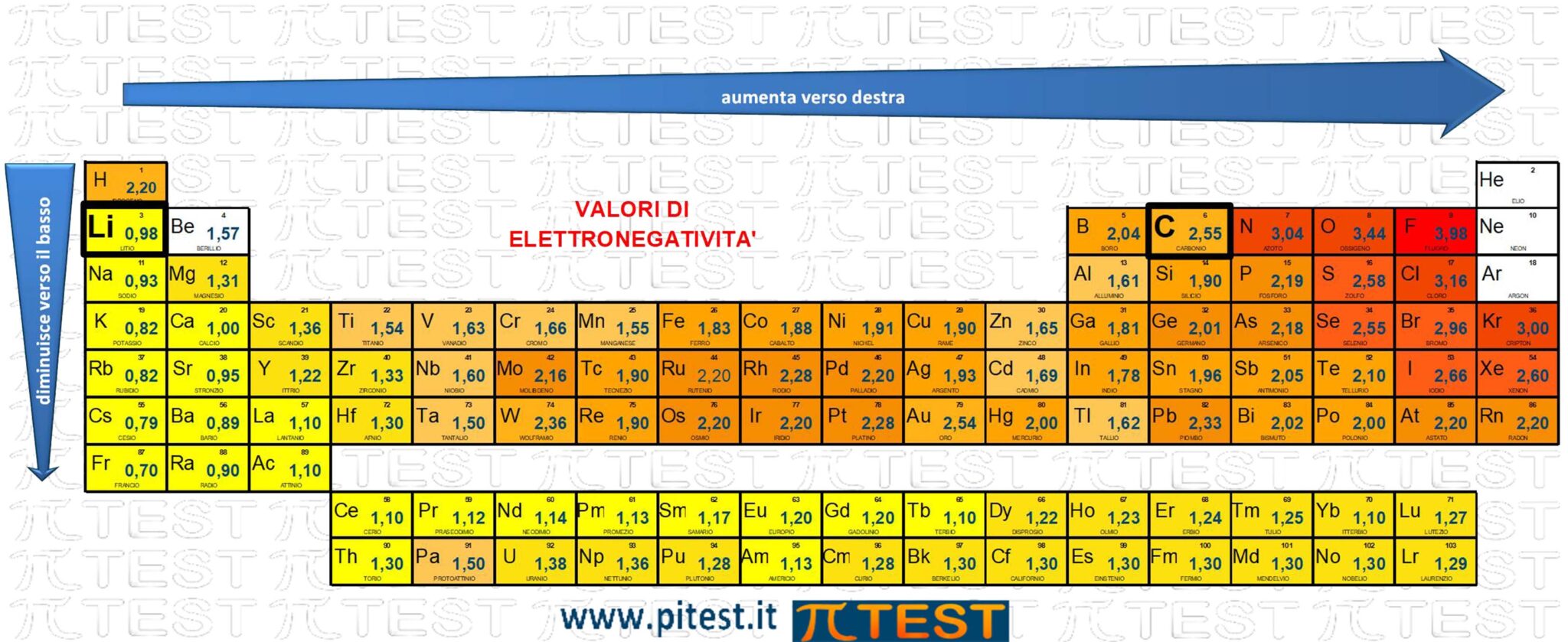
D) è minore nel Carbonio che nel Litio - ERRATO
Carbonio C e litio Li appartengono allo stesso periodo. Il carbonio si trova più a destra ed ha maggiore elettronegatività.
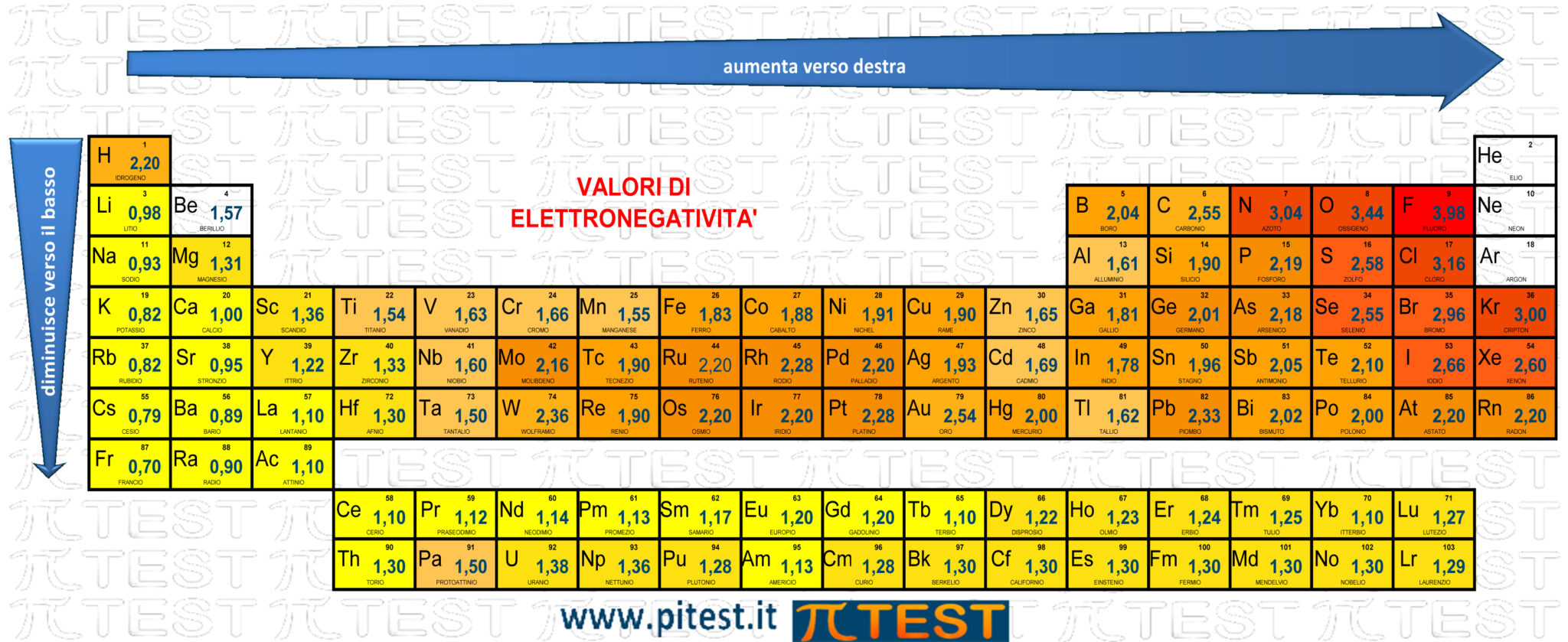
E) è maggiore nel Fluoro che nell’Ossigeno - CORRETTO
Fluoro F e ossigeno O appartengono allo stesso periodo. Il fluoro si trova più a destra ed ha maggiore elettronegatività.