Medicina 2004
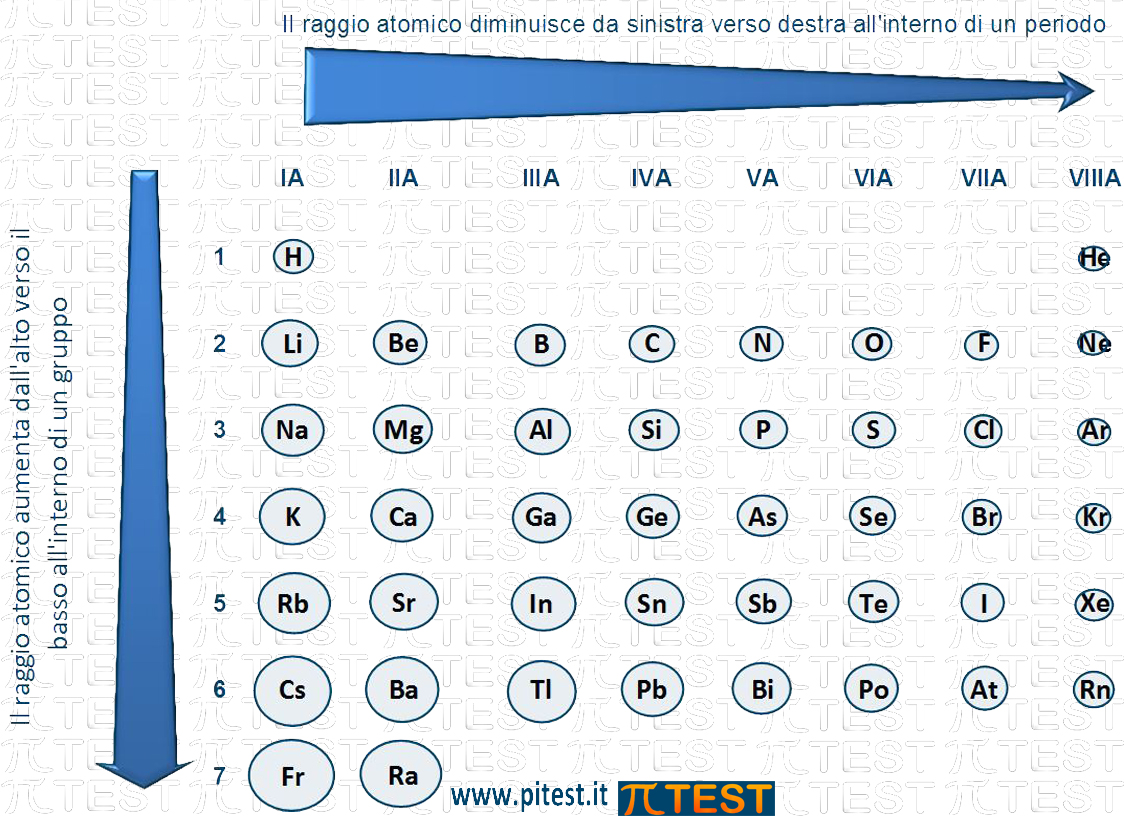
Lungo un periodo della tavola periodica, dal I al VII gruppo, il raggio atomico:
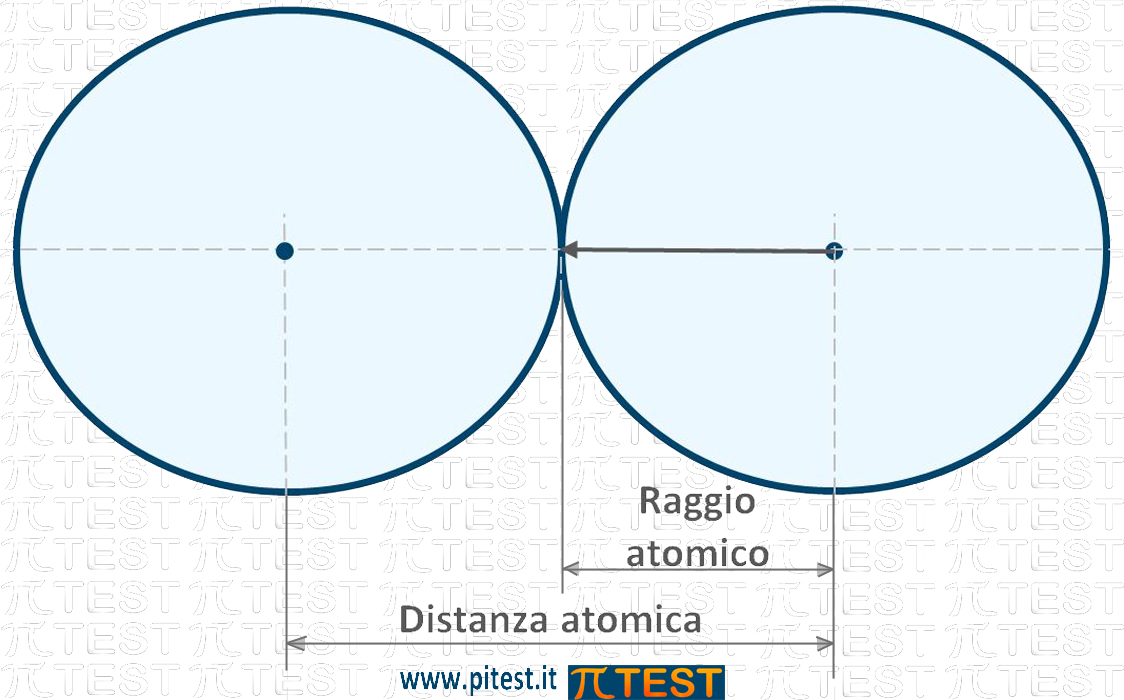
Assimilando la forma di un atomo ad una sfera, parlare del suo raggio equivale a parlare della dimensione atomica. Per una definizione più rigorosa immaginiamo due atomi identici che si avvicinano il più possibile e andiamo a misurare questa minima distanza che divisa per due fornisce il raggio atomico. Il raggio atomico misura in pratica la “grandezza di un atomo.
Il raggio atomico viene misurato in picometri (1pm=10-12m) oppure in angstrom (1Å = 10-10m).
Come esempio consideriamo il più piccolo ed il più grande: Il raggio atomico dell’idrogeno vale 53pm (0,53Å) e il raggio atomico dell’uranio vale 156pm (15,6Å)
Spostiamoci dall’alto verso il basso all’interno di un gruppo, ad esempio nel primo gruppo dei metalli alcalini.
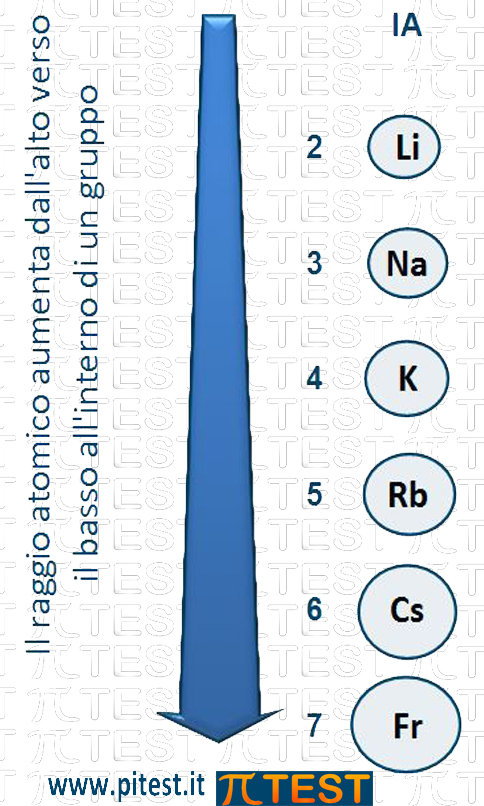
Incontriamo in alto il litio Li che contiene due elettroni nel primo livello ed un solo elettrone nel secondo livello (1s22s1); l’elemento sottostante, il sodio (1s22s22p63s1) possiede due livelli pieni di elettroni ed un solo elettrone nel terzo livello. Per quanto riguarda le dimensioni atomiche il sodio è più grande del litio perché la sua nuvola elettronica è più grande di un livello. Il discorso si ripete scendendo al potassio e poi al rubidio, al cesio e al francio.
In generale possiamo affermare che spostandosi da sinistra verso destra lungo un periodo la dimensione atomica diminuisce.
Spostiamoci da sinistra verso destra all’interno di un periodo, ad esempio nel secondo periodo che va dal litio Li al neon Ne.

Il litio Li possiede un nucleo con 3 protoni e i suoi elettroni arrivano ad occupare il secondo livello o secondo guscio elettronico (1s22s1). L’elemento successivo lungo il periodo è il berillio Be che possiede un propone in più (da 3 a 4) i suoi elettroni arrivano ad occupare il secondo livello o secondo guscio elettronico (1s22s2) così come il litio. Il guscio elettronico più esterno rimane lo stesso. Il nucleo del berillio rispetto al litio ha aumentato la sua carica positiva che attira gli elettroni esterni (negativi) con più forza provocando un restringimento della nuvola di elettroni.
Se continuiamo verso destra dal berillio Be al boro B, possiamo ripetere lo stesso ragionamento. In generale possiamo affermare che spostandosi da sinistra verso destra lungo un periodo la dimensione atomica diminuisce.
Andamento del raggio atomico