Medicina 2004
” Gli alogeni, elementi del VII gruppo del sistema periodico (dall’alto in basso fluoro, cloro, bromo, iodio ed astato), sono tipici non metalli, come si rileva dai valori molto alti dell’elettronegatività, che nel fluoro raggiunge il valore massimo di 4,0. Tutti questi elementi presentano, nell’ultimo livello, un elettrone in meno rispetto al gas nobile più vicino, e ciò spiega la loro grande facilità a formare ioni monovalenti negativi ”.
Quale delle seguenti affermazioni PUÒ essere dedotta dalla lettura del brano precedente?
Il testo del quiz parla di due proprietà degli elementi: l'elettronegatività e la formazione di ioni.
1) L'elettronegatività segue lo schema che troviamo nella figura seguente. L'elettronegatività assume valori crescenti se ci spostiamo verso destra in uno stesso periodo e decrescenti verso il basso lungo uno stesso gruppo. Quest'ultima caratteristica viene ricordata dal testo che dice che il valore maggiore si ha per il fluoro (e di conseguenza a decrescere scendendo). La risposta A) è sicuramente esatta. 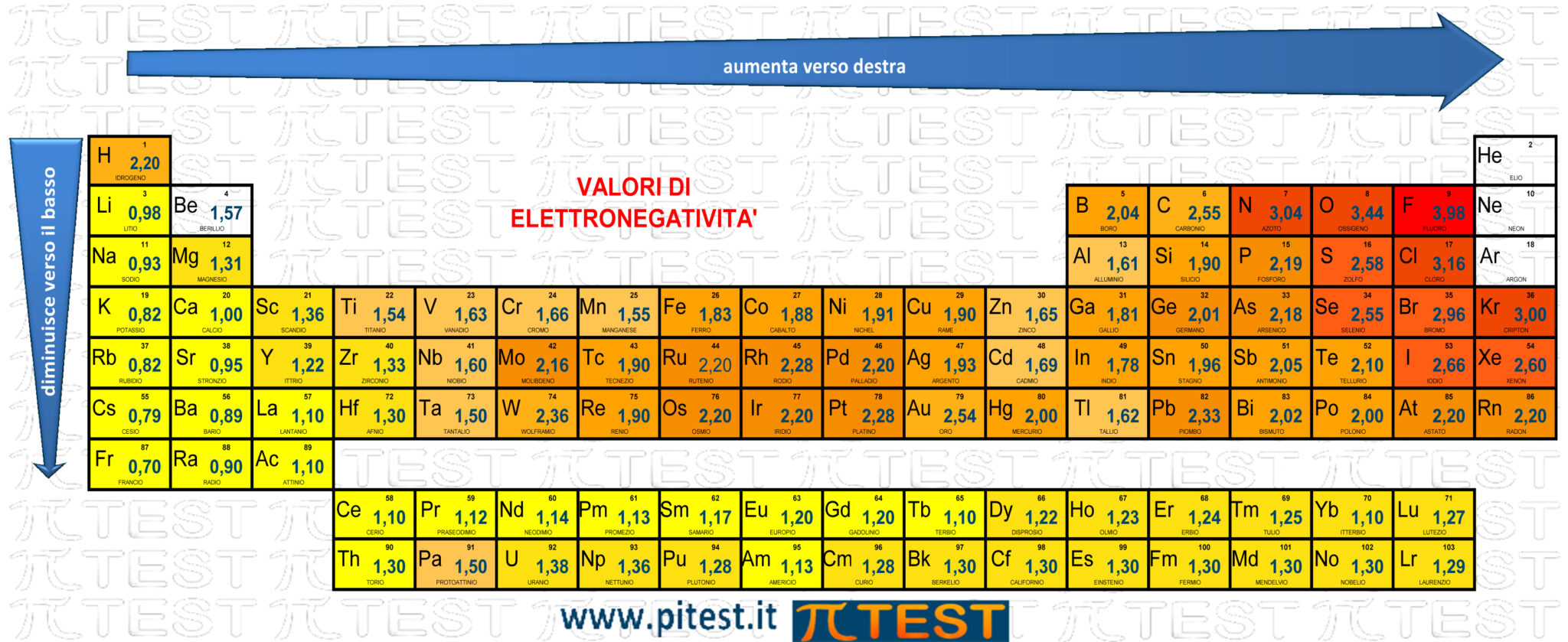 2) La formazione di ioni avviene acquistando un elettrone. Rappresentiamo la reazione utilizzando come esempio il fluoro F:
2) La formazione di ioni avviene acquistando un elettrone. Rappresentiamo la reazione utilizzando come esempio il fluoro F:
F + e– → F–
Acquistando un elettrone l'alogeno, che già possedeva sette elettroni nel guscio di valenza, raggiunge la configurazione di ottetto completo che conferisce stabilità allo ione.
Valutiamo le altre risposte:
B) Gli alogeni presentano nell’ultimo livello 6 elettroni
Errato. ne possiede 7.
C) Gli ioni monovalenti negativi formati dagli alogeni presentano nell’ultimo livello 7 elettroni
Errato. Lo ione monovalente negativo (ad esempio F–) possiede l'ottetto completo.
D) Nel gruppo degli alogeni l’elettronegatività è minore in alto che in basso
Al contrario, come afferma la risposta A).
E) Gli ioni monovalenti negativi formati dagli alogeni presentano nell’ultimo livello 6 elettroni
Errato. Lo ione monovalente negativo (ad esempio F–) possiede l'ottetto completo.


