6.3 La resa di una reazione
QUIZ 01
Medicina 2015
Quando 1,2 g di magnesio reagiscono completamente con acido solforico diluito e in eccesso, il magnesio solfato prodotto viene separato, disidratato e ha un peso finale di 5,5 g. La reazione è:
Mg + H2SO4 → MgSO4 + H2
Qual è la resa di magnesio solfato in percentuale?
“Si assuma massa atomica relativa: Mg = 24; S = 32; O = 16”
Il quiz presenta una reazione chimica senza specificare che deve essere bilanciata. Possiamo perciò assumere che il bilanciamento (di per sé comunque semplice) sia già effettuato. Si tratta di una reazione con proporzioni di reazione
1 : 1 ➝ 1 : 1
Si parla di H2SO4 in eccesso che può essere utilizzato liberamente dalla reazione senza limitazioni.
Il testo parla di resa e perciò possiamo capire che la reazione avrebbe potuto produrre più di 5,5 g di solfato di magnesio. Calcoliamo così il valore teoriche che la reazione poteva produrre e poi calcoliamo la resa percentuale.
Per utilizzare le proporzioni stechiometriche dobbiamo convertire 1,2g di Mg in moli:
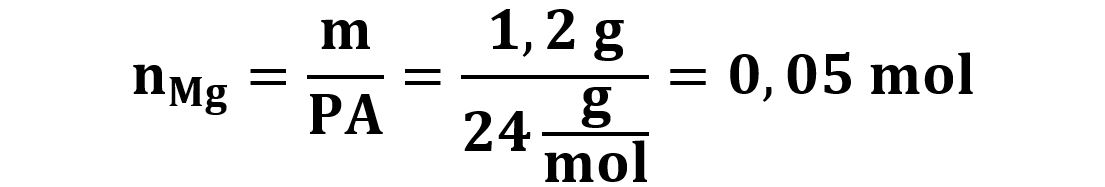 Grazie alla proporzione della reazione deduciamo che avremo come prodotto 0,05 moli di MgSO4 che trasformiamo in massa dopo aver calcolato il PM del MgSO4
Grazie alla proporzione della reazione deduciamo che avremo come prodotto 0,05 moli di MgSO4 che trasformiamo in massa dopo aver calcolato il PM del MgSO4
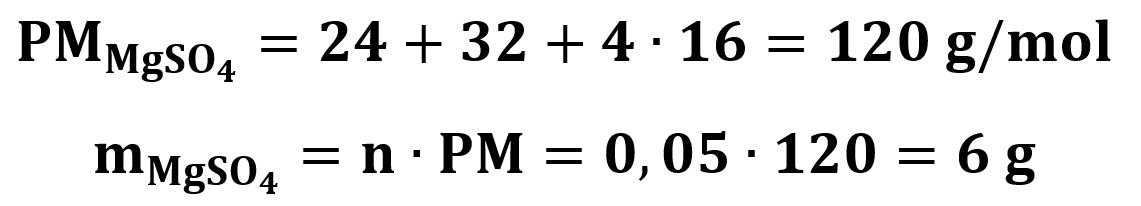 Come avevamo già intuito dal testo, la quantità teorica di MgSO4 è superiore a quella effettivamente prodotta. Calcoliamo così la resa:
Come avevamo già intuito dal testo, la quantità teorica di MgSO4 è superiore a quella effettivamente prodotta. Calcoliamo così la resa:
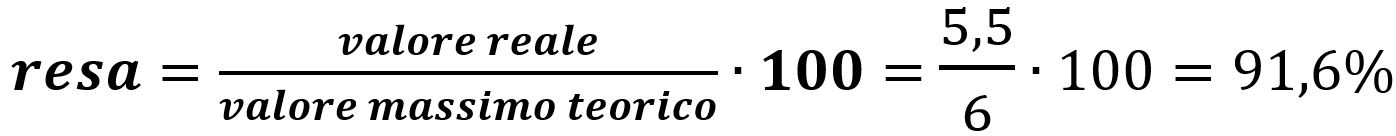 La risposta corretta è la B).
La risposta corretta è la B).
Suggerimenti di calcolo:
I calcoli da effettuare nella soluzione del quiz sono vari e possono richiedere più tempo di quanto se ne disponga. Se invece di svolgere i singoli calcoli si riportano le forme matematiche non calcolate, si può trovare una via di semplificazioni finali.
1) Se invece di considerare 0,05 moli di Mg, si considera 1,2/24, possiamo riportare questa scrittura nel calcolo lella massa di MgSO4: (1,2/24)·120.
In questa scrittura possiamo semplificare 120 con 24 arrivando agevolmente al risultato:
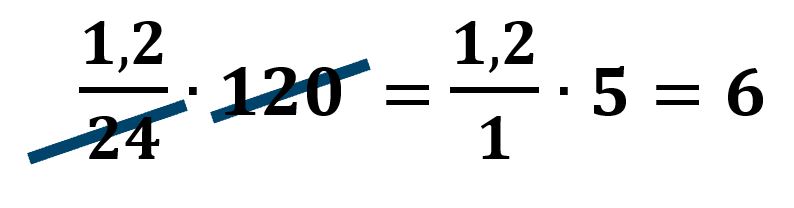
2) Nel calcolo della resa (5,5/6)·100=550/6
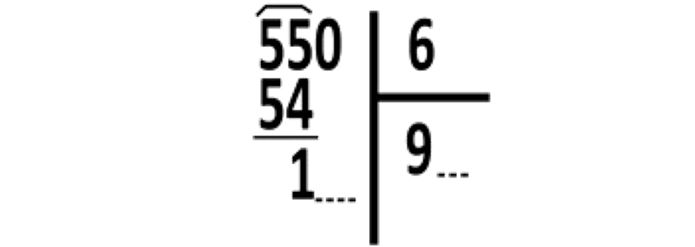
Non appena nel risultato si individua la cifra delle decine 9, si può individuare la risposta B), unica ad avere il valore delle decine 9.
QUIZ su La resa di una reazione |
|||
|---|---|---|---|
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito


