9.1 Autoprotolisi
QUIZ 02
A 60 °C, il prodotto ionico dell’acqua (Kw) ha un valore pari a 9,5⋅10−14. A questa temperatura l’acqua pura:
L’acqua, anche in assenza di qualsiasi sostanza disciolta, effettua la reazione di autoprotolisi o autodissociazione. Ovvero alcune molecole d’acqua si scindono, in piccolissima parte, negli ioni H+ e OH‒ secondo la reazione:
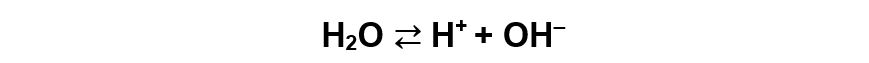
Si tratta di una reazione di equilibrio per la quale si considera una costante di equilibrio kw definita da:
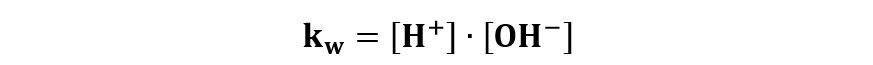
detta anche prodotto ionico dell’acqua.
Normalmente il suo valore viene definito alla temperatura di 25°C e alla pressione di 1atm, dette “Condizioni Normali”, e vale 1∙10-14 . Questo è il valore spesso utilizzato nei quiz di calcolo.
Come ogni altra costante di equilibrio però, kw varia al variare della temperatura e a 60°C assume il valore indicato nel testo del quiz 9,5∙10-14, valore superiore a quello relativo alle condizioni normali. Il che significa che all’aumentare della temperatura aumenta anche il numero di molecole d’acqua che subiscono autodissociazione.
Con un ragionamento simile a quello visto nel precedente quiz n.37, possiamo ricavare le concentrazioni di H+ e di OH‒ conoscendo il valore di kw.
Poiché da una molecola d’acqua si genera esattamente un H+ e un OH‒, possiamo dedurre che la concentrazione di H+ e quella degli OH‒ sono identiche e le indichiamo con la variabile x.
Ne risulta:
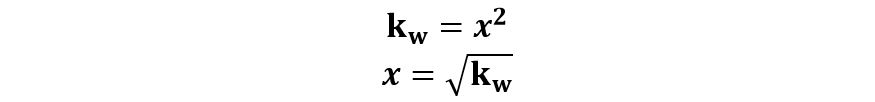
In Condizioni Normali (25°C) si ricava
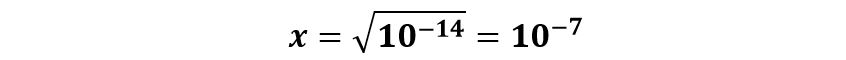
Da questo valore si potrà dedurre che il valore di pH dell’acqua neutra in Condizioni Normali sia pari al valore 7:
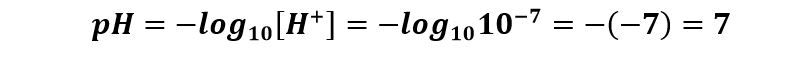
Nelle nostre condizioni indicate dal quiz avremo che la concentrazione degli ioni H+ è ricavabile da:
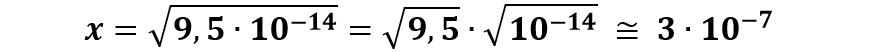
Poiché 3∙10-7 è maggiore di 10-7 avremo che -log10 3∙10-7 è minore di -log10 1∙10-7
In altri termini:
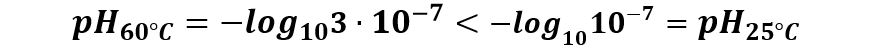
© il testo è di esclusiva proprietà dell’autore ed è sottoposto a COPYRIGHT – non è consentito alcun utilizzo diverso dallo studio gratuito degli utenti del sito


