Veterinaria 2003
“Tutti gli elementi del VII gruppo del sistema periodico (alogeni) possiedono, nell’ultimo livello, due elettroni di tipo s e cinque di tipo p, di cui uno disaccoppiato. Essi hanno pertanto tendenza a formare ioni monovalenti negativi, acquistando un elettrone e comportandosi quindi come energici ossidanti; la loro alta reattività giustifica altresì il fatto che gli alogeni non sono generalmente presenti in natura allo stato libero, ma combinati con altri elementi”.
Quale delle seguenti affermazioni PUÒ essere dedotta dalla lettura del brano precedente?
Tutti gli alogeni terminano la configurazione elettronica con s2 p5. Manca un sesto elettrone per completare il guscio di valenza (completamento dell'ottetto).
Per capire meglio vediamo lo schema della configurazione elettronica del primo alogeno della serie, il fluoro.
I tre orbitali p sono rappresentati con tre caselline nelle quali possono trovarsi al massimo due elettroni (rappresentati da freccette) con spin opposto (Lo spin è rappresentato dal senso della freccia). L'orbitale p che non possiede la coppia di elettroni è detto disaccoppiato.
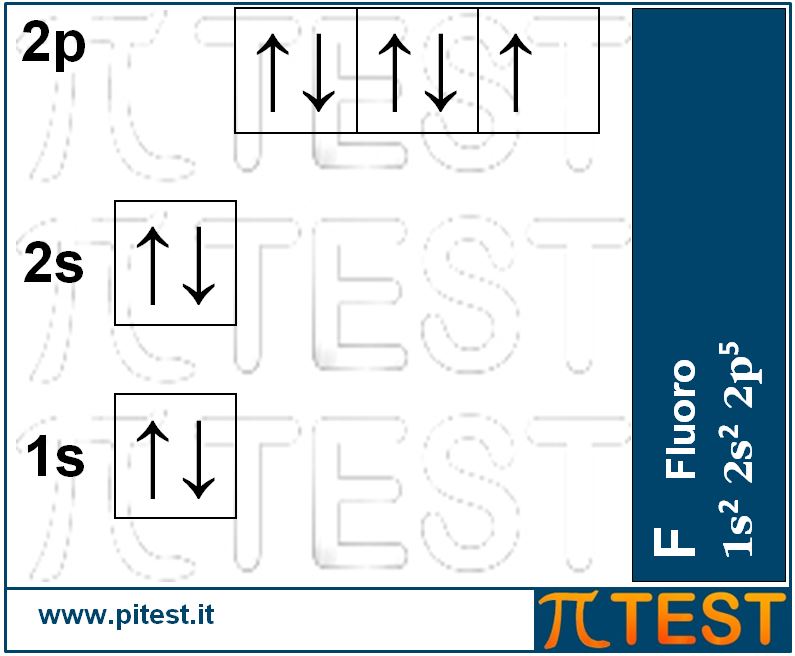
Il testo del quiz parla della formazione di anioni monovalenti da parte degli alogeni. La reazione di cui parla la rappresentiamo utilizzando come esempio il fluoro F:
F + e– → F–
Quando un elemento acquista elettroni si sta riducendo e permette l'ossidazione di altri elementi grazie agli elettroni che incamera; si dice che svolge il ruolo di agente ossidante (fa ridurre gli altri). Troviamo questo concetto esposto correttamente nella risposta D).
Analizziamo le altre risposte:
A) Gli atomi degli alogeni tendono a cedere elettroni
Al contrario tendono ad accettare un elettrone.
B) L'elettrone disaccoppiato degli alogeni si trova nell'orbitale s dell’ultimo livello
L'orbitale disaccoppiato è uno dei tre orbitali p, non l'orbitale s.
C) Gli alogeni hanno una notevole tendenza ad ossidarsi
Al contrario tendono a ridursi come correttamente espresso nella risposta D).
E) Gli alogeni tendono a formare composti con altri elementi formando legami covalenti
La tendenza ad acquistare un elettrone formando anioni monovalenti è talmente spinta che avremo facilmente la formazione dello ione che creerà poi legami ionici e non covalenti.


